
| 序号 | 物质 | 试剂 | 除杂方法 |
| ① | 甲烷(C2H4) | ||
| ② | 溴苯?(溴) |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z<Y<W,而离子半径:W<Y<Z | |
| B. | 含W的盐溶液一定呈酸性 | |
| C. | 由X、Y、Z组成的盐的水溶液呈酸性,则溶液中该盐阳离子浓度大于酸根离子浓度 | |
| D. | W和Y形成的原子个数比为1:1的共价化合物,具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域,是一种原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| B. | 标准状况下,2.24LCl2与过量的稀NaOH 溶液反应,转移电子总数为0.2NA | |
| C. | 0.1mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| D. | 标准状况下,22.4L苯中C-H键数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
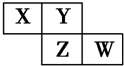 15、X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子最外层电子数是内层电子数的3倍,下列说法中正确的是( )
15、X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | Z、W的气态氢化物还原性:W>Z | |
| D. | 四种元素的单质中,Z单质的熔沸点最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铜电极上发生还原反应 | |
| B. | 电池工作时,铜电极附近会出现蓝色 | |
| C. | 锌片失去的电子通过番茄汁流向铜电极 | |
| D. | 工作一段时间后,两极质量均减轻 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 14、一定条件下,VL的密闭容器中充入2molH2(气)和2mol I2(气),发生反应:H2(气)+I2(气)?2HI(气),实验过程中的速率与时间的变化关系如图所示.下列说法正确的是( )
14、一定条件下,VL的密闭容器中充入2molH2(气)和2mol I2(气),发生反应:H2(气)+I2(气)?2HI(气),实验过程中的速率与时间的变化关系如图所示.下列说法正确的是( )| A. | 阴影部分面积表示H2物质的量浓度的减少 | |
| B. | 反应达到限度时,H2、I2、HI的物质的量浓度比一定为1:1:2 | |
| C. | 当容器中密度保持不变时,说明反应一定达到平衡状态 | |
| D. | 若0~10s内,HI的平均速率为0.01mol/(L•s),10s时H2余1.9mol,则容器体积V为2L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 路线:
路线:
 .
.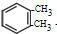 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$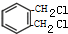 +2HCl
+2HCl
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com