
1.52g铜镁合金完全溶解于50mL密
度为1.40g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。
(1)该合金中铜与镁的物质的量之比是 。
(2)NO2和N2O4的混合气体中,NO2的体积分数是 。
(3)得到2.54 g沉淀时,加入NaOH溶液的体积是 mL
【知识点】本题考查化学方程式的有关计算;有关混合物反应的计算
【答案解析】(1)2:1
(2)80℅
(3)640mL
解析:(1).金属离子全部沉淀时,得到2.54g沉淀为氢氧化铜、氢氧化镁,故沉淀中氢氧根的质量为2.54g-1.52g=1.02g,氢氧根的物质的量为1.02g/17g/mol=0.06mol,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根的物质的量,令铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则:2x+2y=0.06 ,64x+24y=1.52,解得x=0.02,y=0.01,故合金中铜与镁的物质的量之比是0.02mol:0.01mol=2:1。(2).NO2和N2O4混合气体的物质的量为: 1.12L÷22.4L/mol=0.05mol,令二氧化氮的物质的量为amol,则四氧化二氮的物质的量为(0.05-a)mol,根据电子转移守恒可知,a×1+(0.05-a)×2×1=0.06,解得a=0.04,NO2的体积分数是80℅.(3)反应后溶质为硝酸钠,根据氮元素守恒可知,硝酸钠的物质的量为0.05L×14mol/L-0.04mol-(0.05-0.04)×2=0.64mol,根据钠离子守恒可知n(NaOH)=n(NaNO3)=0.64mol,故需要氢氧化钠溶液的体积为0.64mol÷1mol/L=0.64L=640mL,
【思路点拨】本题考查混合物的有关计算,难度中等,理解反应发生的过程是关键,是对学生综合能力的考查,注意根据守恒思想进行的解答


科目:高中化学 来源: 题型:
生产、生活离不开各种化学物质,下列说法不正确的是( )
A.不需要通过化学反应就能从海水中获得食盐和淡水
B.潜水艇在紧急情况下可用过氧化钠供氧
C.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
D.“加碘盐”、“高钙牛奶”、“补铁营养品”等食品中的碘、钙、铁是指单质
查看答案和解析>>
科目:高中化学 来源: 题型:
元素X、Y、Z、W均为短周期元素,且原子序数依次增大。已知Y原子最外层电子数
占核外电子总数的3/4,W—、Z+、X+半径逐渐减小,化合物XW常温下为气体,Z是本周
期中除稀有气体元素外,原子半径最大的元素,据此回答下列问题:
(1)Z在元素周期表中的位置 ,工业上生产Z单质的化学方程式为
(2)A、B均为由上述四种元素中的三种组成的强电解质,且常温下两种物质的水溶液pH均大于7,组成元素的原子数目比均为1∶1∶1。若A能抑制水的电离,而B能促进水的电离,则A、B的化学式分别为 、 。
(3)C是由上述四种元素的两种组成的相对分子质量为34的化合物,则C的电子式 。
(4)用B在碱性条件下可以处理CN—的工业废水,请将下列6种微粒:CN—、CO32—、N2、OH—、B的阴离子,W的阴离子,分别填入在下对应的横线上,组成一个配平的离子方程式: + + ═ + + + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.195g锌粉加入到20.0mL的0.100 mol·L-1MO2+ 溶液中,恰好完全反应,则还原产物可能是( )
A.M B.M2+ C.M3+ D.MO2+
查看答案和解析>>
科目:高中化学 来源: 题型:
NH3是一种重要的化工产品,是制造铵盐的原料。
(1)实验室用图1所示装置制备氨气,该反应的化学反应方程式为 。
检验氨气的方法是 。

图1 图2 图3
(2)实验室也常用图2所示的简易装置制备氨气,下列说法正确的是 (填字母序号)。
a.锥形瓶中加入的固体物质可以是碱石灰
b.制得的氨气可用碱石灰来干燥
c.可用图3装置和试剂对氨气进行尾气处理
(3)氯化铵常用作除锈剂,用化学用语表达其水溶液呈酸性的原因是 。
(4)工业上用活性炭做催化剂,在280~450℃条件下氯化铵与甲醇(CH3OH)反应制取一氯甲烷(CH3Cl),该反应的化学方程式为 。
(5)工业合成氨:N2+3H2 2NH3。已知断开1 mol化学键所需的能量见下表。
2NH3。已知断开1 mol化学键所需的能量见下表。
|
| N≡N | H—H | N—H |
| 键能/kJ·mol-1 | 945 | 436 | 391 |
则运用键能数据计算,该反应的ΔH约为 kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
Fe2O3、ZnO、CuO的固体混合粉末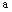 克,在加热条件下用足量CO还原,得到金属混合物2.41克,将生成的CO2气体用足量的澄清石灰水吸收后,产生5.00克白色沉淀,则a的数值为 ( )
克,在加热条件下用足量CO还原,得到金属混合物2.41克,将生成的CO2气体用足量的澄清石灰水吸收后,产生5.00克白色沉淀,则a的数值为 ( )
A.7.41B.3.59C.3.21D.2.46
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、X均为常见的纯净物,它们之间有如下转化关系(副产品已略去)。
 |
试回答:
(1)若X是强氧化性单质,则A不可能是 。
a. S b. N2 c. Na d. Mg e. Al
(2)若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀,检验此C溶液中金属元素价态的操作方法是: 。则B的化学式为 。
(3)若A、B、C为含某金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,B为两性化合物,则X的化学式可能为(写出不同类物质) 或 ,
反应①的离子方程式为(写一条) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4︰1,其d轨道中的电子数与最外层电子数之比为5︰1。
(1)Z与X形成只含一个中心原子的共价化合物,则它的分子式是 ,其分子的立体结构是 。
(2)Y的最高价氧化物晶体类型是 晶体。X的氧化物与Y的最高氧化物中,分子极性较小的是(填分子式) 。
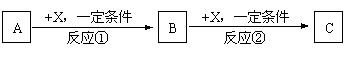
(3)右图是W的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 。(图中实心球表示W元素)
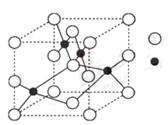
(4)铜元素和W元素都位于周期表的ds区,胆矾
CuSO4·5H2O可写成[Cu(H2O)4]SO4 ·H2O,其结构示意图如右,有关它的说法正确的是 ________(填字母)。
A.该胆矾晶体中存在配位键、共价键和离子键
B.该结构中还存在金属键,极性共价键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(5)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,单NF3不易与Cu2+形成配离子,其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com