
分析 (1)CH3COOH溶液加水稀释过程,促进电离,c(H+)减小,c(OH-)增大,Kw不变;
(2)①根据溶液中的电荷守恒和物料守恒来计算;
②25℃时,混合液pH=6,溶液呈酸性,说明醋酸的电离程度大于醋酸根的水解程度,据此判断离子浓度大小顺序;25℃时,混合液pH=6,c(H+)=1.0×10-6mol/L,则由Kw可知,c(OH-)=1.0×10-8mol/L,由电荷守恒可知,c(CH3COO-)-c(Na+)=c(H+)-c(OH-),根据缓冲溶液中的缓冲公式来计算c(CH3COO-)/c(CH3COOH).
解答 解:(1)A.CH3COOH溶液加水稀释过程,虽促进电离,但c(H+)减小,故A不选;
B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{n({H}^{+})}{n(C{H}_{3}COOH)}$,CH3COOH溶液加水稀释过程,促进电离,氢离子物质的量增大,醋酸物质的量减小,则稀释过程中比值变大,故B选;
C.稀释过程,c(H+)减小,c(OH-)增大,c(H+)•c(OH-)=Kw,Kw只受温度影响所以不变,故C不选;
D.稀释过程,c(H+)减小,c(OH-)增大,则$\frac{c(O{H}^{-})}{c({H}^{+})}$变大,故D选;
故答案为:BD;
(2)25℃时,混合液pH=6,溶液呈酸性,c(H+)>c(OH-),说明醋酸的电离程度大于醋酸根的水解程度,故c(CH3COO-)>c(Na+),醋酸的电离程度不大,故离子浓度大小顺序c(CH3COO-)>c(Na+)>c(H+)>c(OH-),①CH3COOH与CH3COONa的混合溶液中,存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),所以c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6mol/L-10-8mol/L=9.9×10-7mol/L,故答案为:9.9×10-7;
②根据缓冲公式pH=pKa-lg($\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$),25℃时CH3COOH的 Ka=1.8×10-5,pKa(CH3COOH)=4.76,所以lg($\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$)=-1.24,即$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=18,
故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);18.
点评 本题考查pH与酸的稀释等,注意水解规律中越弱越水解和稀释中强的变化大来分析解答,综合性较大,题目难度中等.


科目:高中化学 来源: 题型:解答题
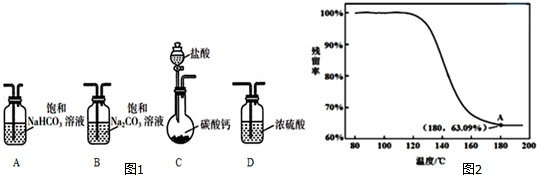
NaHCO3溶液 BaCl2浓度 | 0.2mol•L-1 | 0.1mol•L-1 | 0.02mol•L-1 |
| 0.2mol•L-1 | 浑浊 | 浑浊 | 少许浑浊 |
| 0.1mol•L-1 | 浑浊 | 少许浑浊 | 无现象 |
| 0.02mol•L-1 | 少许浑浊 | 无现象 | 无现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,0.1mol D216O中含中子数、质子数、电子数均为NA | |
| B. | 比黄金还贵的18O2和普通的16O2是两种不同的核素 | |
| C. | 标准状况下,2.24LCl2溶于水,转移的电子数目为0.1NA | |
| D. | 1L2mol•L-1的Al(NO3)3溶液中含Al3+个数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 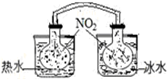 依据两容器内气体颜色变化,判断反应2NO2(g)?N2O4(g)平衡移动的方向 | |
| B. | 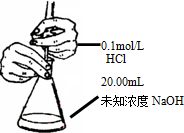 测定锥形瓶内的NaOH的浓度 | |
| C. | 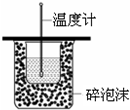 测定中和热 | |
| D. | 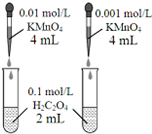 依据褪色快慢比较浓度对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Al、Fe、Cu在空气中都易生锈是因为都生成了对应的氧化物 | |
| B. | 在高温下用氢气还原MgCl2可制取金属镁 | |
| C. | 实验测得NH4HCO3溶液显碱性,CH3COONH4溶液显中性,说明酸性CH3COOH>H2CO3 | |
| D. | 高温时,CuO比Cu2O稳定,Na2O2比Na2O稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C1>C2 | B. | C1=C2 | C. | C1<C2 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com