
| A. | 大分子化合物油脂在人体内水解为氨基酸和甘油等小分子才能被吸收 | |
| B. | 包装食品里常有硅胶、石灰、还原铁粉三类小包,其作用相同 | |
| C. | Na2SiO3水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料 | |
| D. | 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 |
分析 A.油脂为高级脂肪酸甘油酯;
B.硅胶、石灰均作干燥剂,铁粉作抗氧化剂;
C.Na2SiO3水溶液俗称水玻璃,不燃烧,具有防腐作用;
D.氯水中含HClO,具有漂白性.
解答 解:A.油脂为高级脂肪酸甘油酯,水解生成高级脂肪酸和甘油,故A错误;
B.硅胶、石灰均作干燥剂,铁粉作抗氧化剂,作用不同,故B错误;
C.Na2SiO3水溶液俗称水玻璃,不燃烧,具有防腐作用,与二氧化碳反应生成硅酸,则是制备硅胶和木材防火剂的原料,故C正确;
D.氯水中含HClO,具有漂白性,不能利用pH试纸测pH,应选pH计测定,故D错误;
故选C.
点评 本题考查物质的组成、结构与性质,为高频考点,把握物质的性质、应用及化学与生活的关系为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:选择题

| A. | 一定含有BaCl2、Mg(NO3)2、NaHCO3、X,且X是NH4HSO4 | |
| B. | 一定不含K2CO3、CuSO4,X是NH4Al(SO4)2 | |
| C. | 一定含有BaCl2、NaHCO3、X且X是NH4AlO2,另一种为NaCl和Mg(NO3)2中的任一种 | |
| D. | 一定含有NaCl、BaCl2、NaHCO3和X,当X不能确定是什么物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液中只含Fe3+、SO42-、Cl- | |
| B. | 溶液中只含Cu2+、SO42- | |
| C. | 需要利用焰色反应才能确定有无Na+ | |
| D. | 溶液中肯定没有I-,但无法确定有无Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

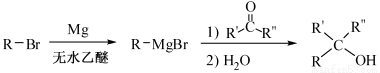
 (R表示烃基,R′和R″表示烃基或氢)
(R表示烃基,R′和R″表示烃基或氢)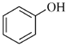 、
、
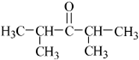 或
或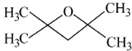 (任写一种)
(任写一种)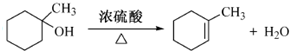
 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

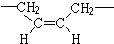 ,若顺丁橡胶的平均相对分子质量为540054,则平均聚合度为10001.
,若顺丁橡胶的平均相对分子质量为540054,则平均聚合度为10001.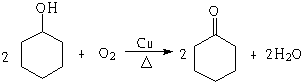 .
.
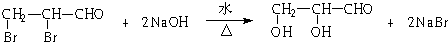 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 银锌纽扣电池工作时,Ag2O被还原为Ag | |
| B. | 碱性锌锰电池中,MnO2是催化剂 | |
| C. | 放电时,铅酸蓄电池中硫酸浓度不断增大 | |
| D. | 电镀时,待镀的金属制品表面发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9种 | B. | 10种 | C. | 11种 | D. | 12种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com