
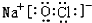
���� A��B��C��D��E��F��GԪ��ԭ��������������G�Ļ�̬ԭ�Ӻ���M�ܲ��������ӣ�N�ܲ�ֻ��1�����ӣ���GΪCuԪ�أ�Cԭ������������������������֮��Ϊ3��4���������������ܳ���8��ԭ��ֻ����2�����Ӳ㣬����������Ϊ6����CΪOԪ�أ�E��Cͬ���壬��EΪSԪ�أ�Bԭ���������3��δ�ɶԵ��ӣ�ԭ�Ӻ�������Ų�Ϊ1s22s22p3����BΪNԪ�أ�F-��D+��A+���ӵİ뾶��С��������AF������Ϊ���壬��AΪHԪ�ء�DΪNa��FΪCl��
��1��CΪOԪ�أ�ԭ�Ӻ��������Ϊ8�������������ԭ����д��������Ų�ʽ��ԭ������ͬ���۵�����Ҳ��ͬ������Ϊ�ȵ����壻
��2������ԭ�ӻ����Ӻ��пչ�������庬�й¶Ե��ӣ���������Ԫ���е�����Ԫ����ɣ�Ϊ������������������Ҫ�ɷ֣�������ΪNaClO��
��3���ֱ���A��C��D��E����Ԫ����ɵ������ο����Ӧ�õ����壬���������������������Ʒ�Ӧ���������ơ�����������ˮ��
��4��G�ĵͼ���������Cu2O��B������������ˮ������HNO3���÷�Ӧ����ʽΪ��3Cu2O+14HNO3=6Cu��NO3��2+2NO+7H2O��
��5��1molҺ̬N2H4��������Һ̬H2O2��Ӧ������N2�����H2O���壬�ų�256.652kJ������Ϊ256.652kJ��$\frac{1mol}{0.4mol}$=641.63kJ��ע�����ʵľۼ�״̬�뷴Ӧ����д�Ȼ�ѧ����ʽ��
��� �⣺A��B��C��D��E��F��GԪ��ԭ��������������G�Ļ�̬ԭ�Ӻ���M�ܲ��������ӣ�N�ܲ�ֻ��1�����ӣ���GΪCuԪ�أ�Cԭ������������������������֮��Ϊ3��4���������������ܳ���8��ԭ��ֻ����2�����Ӳ㣬����������Ϊ6����CΪOԪ�أ�E��Cͬ���壬��EΪSԪ�أ�Bԭ���������3��δ�ɶԵ��ӣ�ԭ�Ӻ�������Ų�Ϊ1s22s22p3����BΪNԪ�أ�F-��D+��A+���ӵİ뾶��С��������AF������Ϊ���壬��AΪHԪ�ء�DΪNa��FΪCl��
��1��CΪOԪ�أ�ԭ�Ӻ��������Ϊ8�������������ԭ������������Ų�ʽΪ1s22s22p4��ԭ������ͬ���۵�����Ҳ��ͬ������Ϊ�ȵ����壬��H3O+��Ϊ�ȵ�������NH3��
�ʴ�Ϊ��1s22s22p4�� NH3��
��2��Cu2+��ˮ���������ṩ�µ��ӶԵ�ԭ����H2O����ԭ�ӣ���������Ԫ���е�����Ԫ����ɣ�Ϊ������������������Ҫ�ɷ֣�������ΪNaClO������ʽΪ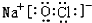 ��
��
�ʴ�Ϊ��O�� ��
��
��3���ֱ���A��C��D��E����Ԫ����ɵ������ο����Ӧ�õ����壬���������������������Ʒ�Ӧ���������ơ�����������ˮ����Ӧ���ӷ���ʽΪ��H++HSO3-=SO2��+H2O��
�ʴ�Ϊ��H++HSO3-=SO2��+H2O��
��4��G�ĵͼ���������Cu2O��B������������ˮ������HNO3���÷�Ӧ����ʽΪ��3Cu2O+14HNO3=6Cu��NO3��2+2NO+7H2O�����ݷ���ʽ֪0.3molCu2O��1.4mol����ǡ����ȫ��Ӧ��
�ʴ�Ϊ��1.4��
��5��1molҺ̬N2H4��������Һ̬H2O2��Ӧ������N2�����H2O���壬�ų�������Ϊ256.652kJ��$\frac{1mol}{0.4mol}$=641.63kJ�����Ȼ�ѧ����ʽΪ��N2H4��l��+2H2O2��l��=N2��g��+4H2O��g����H=-641.63kJ/mol��
�ʴ�Ϊ��N2H4��l��+2H2O2��l��=N2��g��+4H2O��g����H=-641.63kJ/mol��
���� ���⿼��Ƚ��ۺϣ��漰�ṹ����λ�ù�ϵӦ�á���������Ų����ȵ����塢�Ȼ�ѧ����ʽ��д��������ԭ��Ӧ��֪ʶ�㣬��ȷ�ƶ�Ԫ���ǽⱾ��ؼ����Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ö��Ե缫��ⱥ���Ȼ�����Һ��2Cl-+2H+�TH2��+Cl2�� | |
| B�� | ��������Һ������ȩ�е�ȩ����CH3CHO+2Ag��NH3��2++2OH-��CH3COO-+NH4++3NH3+2A����+H2O | |
| C�� | ���ˮ�еμ�FeCl3��Һ�Ʊ����壺Fe3++3H2O�TFe��OH��3��+3H+ | |
| D�� | ��Cl2����ˮ�У�Cl2+H2O�TCl-+2H++ClO- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ϩ���ϵ��ϻ�����Ϊ�����˼ӳɷ�Ӧ | |
| B�� | ˮ�������Ͳ����ϵĴ��̶��ǹ�������Ʒ | |
| C�� | ����ľ�ĵ���Ҫ�ɷֶ�����ά�أ���˿������˿����Ҫ�ɷֶ��ǵ����� | |
| D�� | ����ϴ�ذ�ʱ��84����Һ�ͽ���飨��Ҫ�ɷ������ᣩ���ܻ��ʹ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
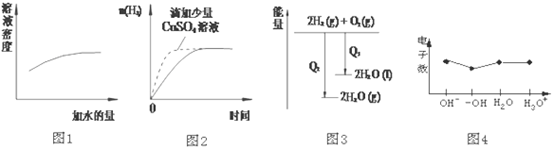
| A�� | ͼ1��ʾŨ�����ϡ�� | |
| B�� | ͼ2��ʾ�����������������п�۷�Ӧ | |
| C�� | ͼ3��ʾ������������Ӧ�е������仯 | |
| D�� | ͼ4��ʾ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �� | B�� | �� | C�� | �� | D�� | ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����������Ԫ��A��B��C��D��E��F��ԭ�����������������ǵ�ԭ�Ӻ�����Ӳ���֮��Ϊ13��B�Ļ���������࣬��Ŀ�Ӵ�C��D�ǿ����к�����������Ԫ�أ�D��E����Ԫ�صĵ��ʷ�Ӧ�����������ֲ�ͬ�����ӻ����FΪͬ���ڰ뾶��С��Ԫ�أ��Իش��������⣺
����������Ԫ��A��B��C��D��E��F��ԭ�����������������ǵ�ԭ�Ӻ�����Ӳ���֮��Ϊ13��B�Ļ���������࣬��Ŀ�Ӵ�C��D�ǿ����к�����������Ԫ�أ�D��E����Ԫ�صĵ��ʷ�Ӧ�����������ֲ�ͬ�����ӻ����FΪͬ���ڰ뾶��С��Ԫ�أ��Իش��������⣺ ��A��C��F����Ԫ���γɵĻ�����CA4FΪ���ӻ��������ӡ����ۡ�����
��A��C��F����Ԫ���γɵĻ�����CA4FΪ���ӻ��������ӡ����ۡ������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | רһ�� | B�� | ������ | C�� | ��Ч�� | D�� | ��Ӧ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com