
| A. | $\frac{1}{20}$mol | B. | $\frac{1}{10}$mol | C. | $\frac{1}{5}$mol | D. | $\frac{2}{5}$mol |
分析 Cu元素的化合价由+2价降低到+1价,CuSO4是氧化剂,P4部分磷元素由0价降低到-3价,部分磷元素由0价升高到+5价,磷元素的化合价既升高又降低,所以P4既是氧化剂又是还原剂,若有11molP4参加反应,其中5mol的P4做氧化剂,60mol硫酸铜做氧化剂,只有6mol的P4做还原剂,结合电子守恒来解答.
解答 解:Cu元素的化合价由+2价降低到+1价,CuSO4是氧化剂,P4部分磷元素由0价降低到-3价,部分磷元素由0价升高到+5价,磷元素的化合价既升高又降低,所以P4既是氧化剂又是还原剂,若有11molP4参加反应,其中5mol的P4做氧化剂,60mol硫酸铜做氧化剂,只有6mol的P4做还原剂,
则由电子守恒可知,有1 mol的CuSO4参加反应,则被硫酸铜氧化的白磷分子的物质的量为$\frac{1mol×(2-1)}{4×(5-0)}$=$\frac{1}{20}$mol,则2molCuSO4能氧化白磷的物质的量是$\frac{1}{10}$mol,
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重电子守恒计算的考查,题目难度不大.


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳原子的L层电子轨道表示式: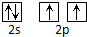 | |
| B. | 氯化氢的电子式: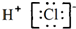 | |
| C. | 硫离子的核外电子排布式:1s22s22p63s23p4 | |
| D. | 碳-12原子:${\;}_{6}^{12}$C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 0 | 10 | 20 | 30 | 40 |
| n(NO2)/mol | 0.400 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、
、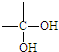 结构非常不稳定,会迅速转变为
结构非常不稳定,会迅速转变为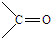
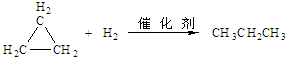
 .
.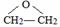 .
.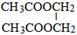 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
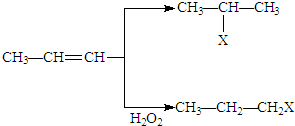 (X为卤素原子)
(X为卤素原子)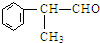 的物质,该物质是一种香料.
的物质,该物质是一种香料.
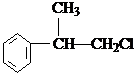 、
、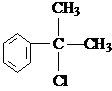 .
.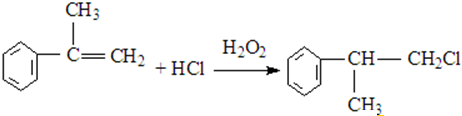 .
. 、
、 、
、 任意2种.
任意2种.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | XY2 | B. | X2Y4 | C. | YX2 | D. | XY |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
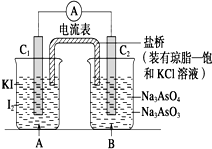 已知反应AsO${\;}_{4}^{3-}$+2I-+2H+?AsO${\;}_{3}^{3-}$+I2+H2O是可逆反应.设计如图装置
已知反应AsO${\;}_{4}^{3-}$+2I-+2H+?AsO${\;}_{3}^{3-}$+I2+H2O是可逆反应.设计如图装置| A. | 操作Ⅰ过程中,C1为正极 | |
| B. | 操作Ⅱ过程中,盐桥中的K+移向B烧杯溶液 | |
| C. | Ⅰ操作过程中,C2棒上发生的反应为AsO${\;}_{4}^{3-}$+2H++2e-=AsO${\;}_{3}^{3-}$+H2O | |
| D. | Ⅱ操作过程中,C1棒上发生的反应为2I--2e-=I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com