
分析 (1)根据n=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$计算;
(2)根据n=cV计算硫酸钠的物质的量,再根据m=nM计算需要硫酸钠的质量;溶液的浓度具有均一性;
(3)氨水溶质为氨气,根据n=$\frac{V}{{V}_{m}}$计算氨气的物质的量,再根据c=$\frac{n}{V}$计算氨水的物质的量浓度;
(4)根据n=$\frac{m}{M}$计算4.5g水的物质的量,与硫酸含有的分子数目相同,则硫酸与水的物质的量相等;二者物质的量相同,具有的氧原子数目之比等于分子中含有的氧原子数目之比;
解答 解:(1)①n=$\frac{34g}{17g/mol}$=2mol,故答案为:2;
②N=nNA=2mol×NA/mol=2NA,故答案为:2;
③V=nVm=2mol×22.4L/mol=44.8L,故答案为:44.8;
(2)配制100mL0.1mol•L-1Na2SO4溶液,需称量Na2SO4的质量为:0.1L×0.1mol/L×142g/mol=1.42g,从所配制溶液中取出5mL,则取出溶液的物质的量浓度为0.1mo1•L-1,故答案为:1.42、0.1mo1•L-1;
(3)2240mL氨气的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,氨水的物质的量浓度为:$\frac{0.1mol}{0.1L}$=1mol/L,故答案为:1;
(4)由硫酸的分子式可知n(H)=n(H2SO4)=2mol,故含有氢原子数目为2mol×6.02×1023mol-1=1.204×1024;4.5g水的物质的量=$\frac{4.5g}{18g/mol}$=0.25mol,与硫酸含有的分子数目相同,则硫酸与水的物质的量相等为0.25mol,二者物质的量相同,具有的氧原子数目之比等于分子中含有的氧原子数目之比为1:4,故答案为:0.25、1:4.
点评 本题考查物质的量的相关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意相关计算公式的运用,难度不大.


 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 配制银氨溶液:向2%的稀氨水中滴入2%的硝酸银溶液,配得银氨溶液 | |
| B. | 实验室制硝基苯:试剂顺序--先加浓H2SO4,再加浓HNO3混合冷却后,最后加苯 | |
| C. | 检验卤代烃消去反应的有机产物:溴乙烷和NaOH的乙醇溶液混合后加热,将产生的蒸汽直接通入酸性高锰酸钾溶液,观察是否褪色 | |
| D. | 鉴别矿物油和植物油:向汽油和植物油中分别加入一定量NaOH溶液加热振荡,观察油层是否消失或变薄 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,180g淀粉水解得到葡萄糖的分子数为NA | |
| B. | 1 mol C10H22分子中共价键总数为31 NA | |
| C. | 室温下,4.4 g乙醛和乙酸乙酯的混合物含有的碳原子数为0.2 NA | |
| D. | 88.0g干冰中含有的共用电子对对数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SiO3 H2S CO2 | B. | H2O NH3•H2O H3PO4 | ||
| C. | H2SO3 BaSO4 CH4 | D. | MgSO4 CH3COOH CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
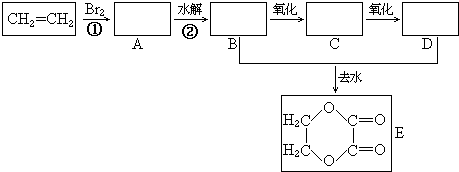
 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性:D>M>N>A | B. | 反应②中H2是氧化产物 | ||
| C. | 金属性:A>N>D>M | D. | 氧化性:M2+>N2+>A2+>D2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
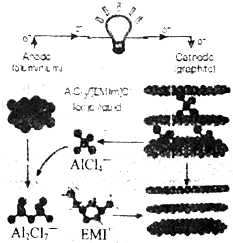 2015年4月,由中美科学家共同完成的“快速充放电铝离子电池”,具有高效耐用、可超快充电、可燃性低、成本低等特点.该电池以金属铝作为负极,三维结构的泡沫石墨材料为正极,AlCl4-可在其中或在脱嵌,由有机离子 (EMI+不参与反应)Al2Cl7-和AlCl4-组成的离子液体做电解质溶液,该电池放电时的原理如图所示,下列说法正确的是( )
2015年4月,由中美科学家共同完成的“快速充放电铝离子电池”,具有高效耐用、可超快充电、可燃性低、成本低等特点.该电池以金属铝作为负极,三维结构的泡沫石墨材料为正极,AlCl4-可在其中或在脱嵌,由有机离子 (EMI+不参与反应)Al2Cl7-和AlCl4-组成的离子液体做电解质溶液,该电池放电时的原理如图所示,下列说法正确的是( )| A. | 放电时,负极的电极反应式:Al-3e-+7AlCl4-═Al2C17- | |
| B. | 充电过程中,AlCl4-脱嵌并从阴极向阳极迁移 | |
| C. | 充电过程中阳极的电极反应式为:Cn+AlCl4--e-═Cn,其中C的化合价升高 | |
| D. | 该离子液体也可用于钢制品上电镀铝,但阴极材料要换成镀件 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com