
| A. | 1:10:104:109 | B. | 1:5:5×109:5×108 | C. | 1:20:1010:109 | D. | 1:10:1010:109 |
分析 根据H20?H++OH-可知,H2SO4溶液、Ba(OH)2溶液抑制水的电离,根据溶液的H2SO4溶液的PH或Ba(OH)2溶液中c(OH-)计算水的电离的物质的量,Na2S溶液、NH4NO3溶液促进水的电离,根据pH可直接求出发生电离的水的物质的量,进而计算物质的量之比.
解答 解:设溶液的体积为1L,
①中pH=0的H2SO4中c(H+)=1.0 mol•L-1,c(OH-)=1.0×10-14mol•L-1,水电离的物质的量为1.0×10-14mol;
②中c(OH-)=0.1 mol•L-1,c(H+)=1.0×10-13mol•L-1,水电离的物质的量为1.0×10-13mol;
③中c(OH-)=1.0×10-4mol•L-1,水的电离的物质的量为1.0×10-4mol;
④中c(H+)=1.0×10-5mol•L-1,水的电离的物质的量为1.0×10-5mol;
故①②③④中水的电离的物质的量之比为:1.0×10-14mol:1.0×10-13mol:1.0×10-4mol1:1.0×10-5mol=1:10:1010:109,
故选D.
点评 本题考查水的电离以及溶液中pH的简单计算,难度不大,做题时注意如何计算水的电离是解答此类题目的关键.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应速率用于衡量化学反应进行的快慢 | |
| B. | 决定反应速率的主要因素是反应物的性质 | |
| C. | 增大反应物的浓度、提高反应温度都能增大反应速率 | |
| D. | 可逆反应达到化学平衡状态时,正、逆反应的速率都为0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
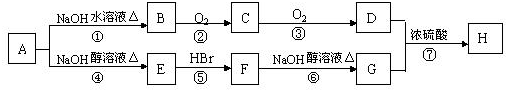
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 云、烟、雾等均能产生丁达尔现象 | |
| B. | PM2.5分散在大气中一般构不成胶体 | |
| C. | “雾霾”、“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关 | |
| D. | 用脱硫处理的煤代替原煤做燃料可以有效减少空气中CO2气体的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式: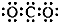 | |
| B. | 质量数为37的氯原子:${\;}_{37}^{17}$Cl | |
| C. | NH4Cl的电子式: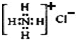 | |
| D. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与浓溴水反应制溴苯 | |
| B. | 向苯酚稀溶液中加过量饱和溴水观察沉淀 | |
| C. | 将乙醛滴入银氨溶液中,直接加热煮沸制银镜 | |
| D. | 1mol•L-1的CuSO4溶液2mL和0.5mol•L-1的NaOH溶液4mL混合后,加入40%的乙醛溶液0.5mL,加热煮沸观察沉淀颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸溶液的导电性比盐酸溶液的弱 | |
| B. | 0.1mol/L乙酸钠溶液的pH约为8 | |
| C. | 把0.1mol/L乙酸溶液温度升高10℃后(不考虑水蒸发),其 pH降低 | |
| D. | 等浓度等体积的乙酸和盐酸在开始与同样大小的镁反应时,盐酸反应快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .从原子结构的角度分析B、N和O的第一电离能由大到小的顺序为N>O>B.
.从原子结构的角度分析B、N和O的第一电离能由大到小的顺序为N>O>B.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com