

| 高温 |
 ,故答案为:
,故答案为: ;
;| 67.2L×3.01×1023 |
| 6×6.02×1023 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
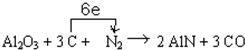
 新型陶瓷氮化铝可用Al2O3高温还原法制备:Al2O3+3C+N
新型陶瓷氮化铝可用Al2O3高温还原法制备:Al2O3+3C+N
| ||
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市长宁、嘉定区高三下学期二模化学试卷(解析版) 题型:填空题
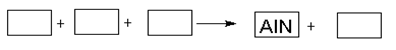
某高温还原法制备新型陶瓷氮化铝(AlN)的反应体系中的物质有:Al2O3 .C.N2.AlN.CO
(1)请将AlN之外的反应物与生成物分别填入以下空格内,配平,并标出电子转移的方向和数目
(2)若反应中共转移3.01 ×1023个电子,则该反应产生气体的体积为: (标准状况下)
(3)氮化铝也能由氯化铝与氨气经气相反应制得:AlCl3+NH3  AlN+3HCl反应中,该方法比前者在生产上更具优势。下列说法中,正确的是 。
AlN+3HCl反应中,该方法比前者在生产上更具优势。下列说法中,正确的是 。
A.前一方法中的 Al2O3.C.N2结构稳定,反应时破坏化学键需要消耗更多的能量
B.前一方法中的Al2O3和C容易残留在氮化铝中
C.两种方法中氮化铝均为还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 AlN+3HCl反应中,该方法比前者在生产上更具优势.下列说法中,正确的是______.
AlN+3HCl反应中,该方法比前者在生产上更具优势.下列说法中,正确的是______.查看答案和解析>>
科目:高中化学 来源:2011-2012学年山西省高三上学期第二次阶段性测试化学试卷 题型:实验题
(11分)新型陶瓷氮化铝可用Al2O3高温还原法制备: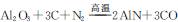 ,用该法制得的产品中常含有少量杂质。某同学拟通过下列实验装置测定产品中AIN的纯度。
,用该法制得的产品中常含有少量杂质。某同学拟通过下列实验装置测定产品中AIN的纯度。
已知:AIN溶于强碱时会生成NH3。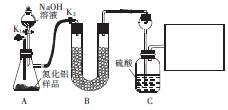
(1)从原料角度分析,AIN中的杂质可能是 ,装置A中产生气体的化学方程式为 。
(2)装置B中的试剂是____;装置C中长颈漏斗的作用是 。
在上图右边的方框中,画出所缺装置图,并注明装置中的试剂。
(3)充分反应后,需打开K1,通入一段时间N2,其目的是 。
(4)若样品的质量为mg,实验前后装置C增重ng,则样品中AIN昀纯度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com