
 �̲�ȫ���ִʾ�ƪϵ�д�
�̲�ȫ���ִʾ�ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��������Һ�У���ˮ�������������Ũ�Ⱦ�Ϊ1��10��11mol��L��1 |
| B���ֱ��ˮϡ��100����������Һ��pH����ͬ |
| C�������е�c(CH3COO��)�������е�c(SO42��)��� |
| D���ֱ��������пƬ��������Һ����H2�������ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��CH3COOH | B��Al2(SO4)3 | C��NaHSO4 | D��Na2CO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��2C4H10+13O2 ="=" 8CO2+10H2O��H=��5 753.6 kJ��mol-1 |
| B��C4H10(g)+13/2 O2(g)==4CO2��g)+5H2O(g)��H=��2 876.8 kJ��mol-1 |
| C��2C4H10(g)+13O2(g)==8CO2��g)+10H2O(l)��H=��2 876.8 kJ��mol-1 |
| D��C4H10(g)+13/2 O2(g)==4CO2��g)+5H2O(l)��H=��2 876.8 kJ��mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��c��CH3COO�������ۣ��� |
| B��ˮ�������c��OH�������ڣ��� |
C���ٺ͢ڵ������Ϻ����Һ�� c��OH ����c��H+��+ c��CH3COOH�� ����c��H+��+ c��CH3COOH�� |
D���ٺ͢۵������Ϻ����Һ�� c��Na+����c��CH3COO������c��H+����c��OH �� �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
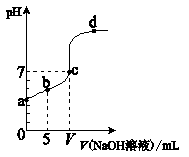
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��1 | B��10-14-a-b /�� | C��10a+b-14/�� | D��10a-b/�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 OH��)Ϊ
OH��)Ϊ| A��2.0��10��7 mol��L��1 | B��0.1��10��7 mol��L��1 |
| C��1.0��10��14/2.0��10��7 mol��L��1 | D����ȷ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 ������ţ���
������ţ���
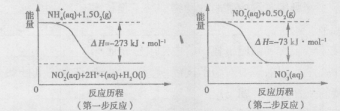
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com