
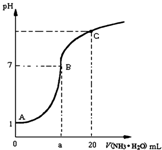
 25℃时,在20mL的盐酸中,逐滴加入0.2mol?L-1的氨水,溶液的pH与氨水体积关系如图所示,则下列说法正确的是( )
25℃时,在20mL的盐酸中,逐滴加入0.2mol?L-1的氨水,溶液的pH与氨水体积关系如图所示,则下列说法正确的是( )| A、滴加前盐酸的物质的量浓度为0.1 mol?L-1 |
| B、B点的横坐标a=10 |
| C、A、B间的任一点,溶液都有c(Cl-)>c(NH4+)>c (H+)>c(OH-) |
| D、如果将氨水换为NaOH溶液,则滴加20mL时溶液的pH一定小于C点的pH |


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案科目:高中化学 来源: 题型:
物质 T/℃n/mol | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.10 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:
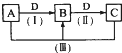 A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示.请回答下列问题.
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时电解质溶液显强酸性 |
| B、充电时阳板反应为Ni(OH)2+2OH--2e-=NiO2+2H2O |
| C、放电时正极附近溶液pH减小 |
| D、充电时阴极附近溶液的碱性保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气可用于自来水的消毒,明矾或铁盐可用来净化水,可推知K2FeO4既能消毒又能净化水 |
| B、配置FeCl3溶液时为防止出现浑浊,应向溶液中加入盐酸抑制Fe3+的水解 |
| C、向纯水中加入盐酸或降温都能使电离平衡逆向移动,但水的离子积不变 |
| D、合成氨生产中将氨气液化分离,提高氢气的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
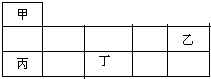 短周期金属元素甲~丁在元素周期表中的相对位置如图所示:下列判断正确的是( )
短周期金属元素甲~丁在元素周期表中的相对位置如图所示:下列判断正确的是( )| A、原子半径:丙>丁>乙 |
| B、单质的还原性:丁>丙>甲 |
| C、甲、乙、丙的氧化物均为共价化合物 |
| D、乙、丙、丁的最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com