
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:阅读理解
| 实验编号 | 温度(K) | 盐酸浓度(mol?L-1) | 醋酸浓度(mol?L-1) | 实验目的 |
| ① | 298 | 0.20 | a.实验①和②是探究 不同温度 不同温度 对镁与盐酸反应速率的影响;b.实验①和③是探究 不同浓度 不同浓度 对镁与盐酸反应速率的影响;c.实验①和④是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别. | |
| ② | 308 | 0.20 | ||
| ③ | 298 | 0.40 | ||
| ④ | 298 298 |
0.20 0.20 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:2012年苏教高中化学选修6 4.1硫代硫酸钠与酸反应速率的影响练习卷(解析版) 题型:实验题
影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1)设计实验方案来研究影响反应速率的因素。
甲同学的实验报告如下表:
|
实验步骤 |
现象 |
结论 |
|
①分别取等体积的2 mol·L-1的硫酸于试管中 ②____________ |
反应速率Mg>Fe,Cu不反应 |
金属的性质越活泼,反应速率越快 |
(1)甲同学表中实验步骤②为____________________________。
(2)甲同学的实验目的是____________________________________________________
________________________________________________________________________;
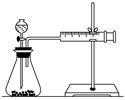
要得出正确的实验结论,还需控制的实验条件是____________。乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验。
(3)乙同学在实验中应该测定的数据是
________________________________________________________________________
________________________________________________________________________。
(4)乙同学完成该实验应选用的实验药品是____________
________________________________________________________________________,
该实验中不选用某浓度的硫酸,理由是______________________________________
________________________________________________________________________。
实验二:已知 2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(5)针对上述实验现象,丙同学认为KMnO4与H2C2O4反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是______________的影响。
(6)若用实验证明你的猜想,除高锰酸钾酸性溶液、草酸溶液外,还需要选择的试剂最合理的是________(填字母)。
A.硫酸钾 B.硫酸锰
C.二氯化锰 D.水
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol?L-1、2mol?L-1、18.4mol?L-1)。设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
| 实验步骤 | 现 象 | 结 论 |
| ①分别取等体积的2 mol?L-1的硫酸于试管中 ② | 反应速率Mg>Fe,Cu不反应 | 金属的性质越活泼,反应速率越快 |
(1)甲同学表中实验步骤②为
。
(2)甲同学的实验目的是 ;要得出正确的实验结论,还需控制的实验条件是 。
乙同学为了更精确的研究浓度对反应速率的影响,利用下图所示装置进行定量实验。

(3)乙同学在实验中应该测定的数据是 。
(4)乙同学完成该实验应选用的实验药品是 。
实验中不选用某浓度的硫酸,理由是 。
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸甲酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(5)针对上述实验现象,丙同学认为KMnO4与H2C2O4反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是 的影响。
(6)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,还需要选择的试剂最合理的是 (填字母)
A.硫酸钾 B.硫酸锰 C.二氯化锰 D.水
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
某化学兴趣小组在做《浓度对化学反应速率的影响》实验时发现,草酸溶液与高锰酸钾溶液反应时,溶液褪色先慢后快。为了探究此反应速率由小变大的原因,甲同学做了如下实验。
(1)0.10mol/L H2C2O4溶液的配制:
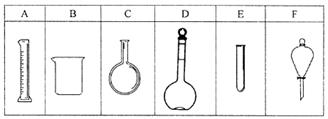
实验室欲配制80mL 0.10mol/L H2C2O4 溶液,需要称取草酸晶体(H2C2O4·2H2O g(精确到0.1g);实验中需要用到的玻璃仪器除了玻璃棒、胶头滴管、量筒外还有: 。(填代号)
(2)反应速率变化的探究
| 1号试管 | 2号试管 | |
| 所加试剂 | 2mL0.10mol/L H2C2O4 溶液, 几滴稀硫酸,4mL0.010mol/L 的KMnO4溶液 | 2mL0.10mol/L H2C2O4 溶液,几 滴稀硫酸,4mL0.010mol/L的 KMnO4溶液,少量MnSO4固体。 |
| 褪色时间 | 31秒 | 4秒 |
①H2C2O4溶液与酸性的KMnO4溶液反应的离子方程式为 。
②甲同学能够得出结论 。
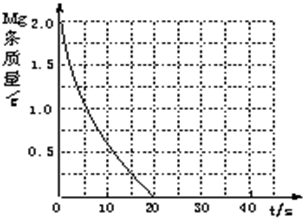
(3)在一定条件下,容积为100 L密闭容器中发生反应:CH4(g)+H20(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
 ΔH>0,将1.O molCH4和2.O mol H 20(g)通入该密闭容器,10 min时有O.1 mol CO生成,则10 min内该反应的平均速率ν(H2) 。
ΔH>0,将1.O molCH4和2.O mol H 20(g)通入该密闭容器,10 min时有O.1 mol CO生成,则10 min内该反应的平均速率ν(H2) 。
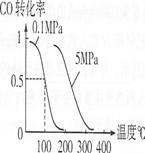
(4)在压强为O.1 MPa条件下,容积为V L某密闭容器中amol CO与2amol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g);CO的转化率与温度、压强的关系如右图所示。
CH3OH(g);CO的转化率与温度、压强的关系如右图所示。
①该反应的AH O(填“<”、“>”或“=”)。
②100℃时该反应的平衡常数K (用含n、V的代数式表示)。
③在其它条件不变的情况下,再增加a mol CO与2a mol H2,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”),平衡常数 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省深圳高级中学高二(上)期中化学试卷(解析版) 题型:解答题
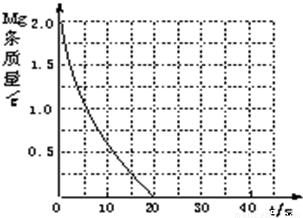
| 实验编号 | 温度(K) | 盐酸浓度 | 醋酸浓度 | 实验目的 |
| ① | 298 | 0.20 | a.实验①和②是探究______对镁与盐酸反应速率的影响; b.实验①和③是探究______对镁与盐酸反应速率的影响; c.实验①和④是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别. | |
| ② | 308 | 0.20 | ||
| ③ | 298 | 0.40 | ||
| ④ | ______ | ______ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com