
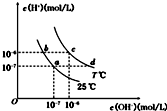
| A. | a点对应的溶液中大量存在:Fe3+、Na+、Cl-、SO42- | |
| B. | b点对应的溶液中大量存在:ClO-、Ba2+、OH-、I- | |
| C. | c点对应的溶液中大量存在:Na+、Ba2+、Cl- HCO3- | |
| D. | d点对应的溶液中大量存在:Na+、K+、SO32-、Cl- |
分析 水的离子积为Kw=c(H+)×c(OH-),由图可知,a、b均在25℃,离子积相同;而c、d均在T℃,离子积相同,并结合离子之间不发生化学反应来解答.
解答 解:A.Fe3+水解显酸性,而a点对应的溶液显中性,则离子不能大量共存,故A错误;
B.b点显酸性,不能大量存在OH-,且ClO-、I-发生氧化还原反应不能共存,故B错误;
C.HCO3-水解显碱性,而c点对应的溶液显中性,则离子不能大量共存,故C错误;
D.d点时c(H+)<c(OH-),溶液为碱性,Na+、K+、SO32-、Cl-不反应,能大量共存,故D正确;
故选D.
点评 本题考查离子的共存,为高频考点,把握酸碱性判断及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存及分析与应用能力的考查,注意T℃>25℃为学生解答的难点,题目难度不大.


科目:高中化学 来源: 题型:解答题
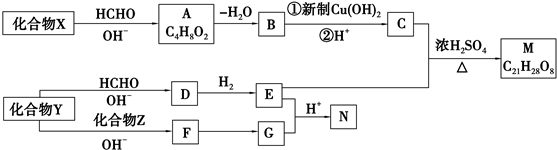
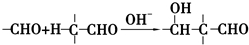
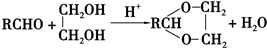
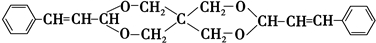
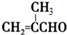 +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$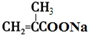 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.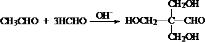 .
.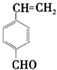 和
和 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸钙有强氧化性,用于饮用水消毒 | |
| B. | 木炭具有还原性,用于制冰箱除味剂 | |
| C. | 氧化铝具有两性,用于工业冶炼铝单质 | |
| D. | 氯化铁溶液呈酸性,用于蚀刻铜电路板 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物可能含共价键 | B. | 共价化合物可能含离子键 | ||
| C. | 离子化合物中只含离子键 | D. | 共价化合物中可能含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙二醇 丙三醇 | B. | C6H5-OH C6H5CH2-OH | ||
| C. | C3H6 和C4H8 | D. | C2H6和C10H22 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C-O | C≡C | H-O | C-H |
| E/(KJ.mol-1) | 436 | 343 | x | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用盐酸除铁锈 Fe2O3+6H+=2Fe3++3H2O | |
| B. | 将Na放入水中 2Na+2H2O=2Na++2OH-+H2↑ | |
| C. | 氢氧化铝溶于盐酸 OH-+H+=H2O | |
| D. | 小苏打与氢氧化钠反应 HCO3-+H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com