
(I)电子工业常用30%的FeCl3。溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2。
(1)写出该反应的化学方程式 。
(2)检验溶液中Fe3+存在的试剂是
(Ⅱ)印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费。通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。
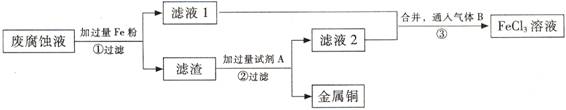 (3) 步骤①中发生反应的离子方程式
(3) 步骤①中发生反应的离子方程式
(4)滤渣的主要成分是 , (填化学式)。
(5)为了除去滤渣中的杂质得到铜,需加入的试剂A是 (填化学式)。
(8分) (1)2FeCl3+Cu==2FeCl2+CuCl2 (2分) (2)KSCN溶液(1分)
(3)2Fe3++Fe=3Fe2+ (1分) Fe+Cu2+=Fe2++Cu (1分)
(4)Cu、Fe (2分) (5)HCI (1分)
【解析】
试题分析:(1)FeCl3溶液做腐蚀液能与Cu反应生成CuCl2和FeCl2,反应的化学方程式是2FeCl3+Cu=2FeCl2+CuCl2。
(2)铁离子能和KSCN溶液反应,溶液显红色,所以检验溶液中Fe3+存在的试剂是KSCN溶液。
(3)铁离子、铜离子都能和铁反应,反应的离子方程式分别是2Fe3++Fe=3Fe2+、Fe+Cu2+=Fe2++Cu。
(4)由于铁是过量的,所以滤渣的主要成分是铁和铜。
(5)铁是活泼的金属,能和盐酸或稀硫酸反应。由于最终要得到氯化铁溶液,所以为了除去滤渣中的杂质得到铜,需加入的试剂A是盐酸而不是稀硫酸。
考点:考查铁及其化合物的性质、铁离子的检验、物质的分离和提纯
点评:该题是中等难度的试题,试题注重基础和能力的双向考查。试题综合性强,注重能力的训练,有利于培养学生的逻辑思维能力和规范的答题能力。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源:2012-2013年广东陆丰碣石中学高一下学期第一次月考化学试卷(带解析) 题型:实验题
(I) 电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2。
(1) 写出该反应的化学方程式 。
(2) 检验溶液中Fe3+存在的试剂是 ,证明Fe3+存在的现象是 。
(Ⅱ) 印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费。通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。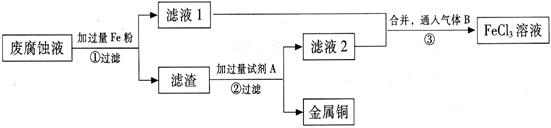
⑴ 步骤①中发生反应的离子方程式 。
(2) 步骤②需加入的试剂A是 (填化学式)。
(3) 步骤③通入的气体B是 (填化学式),写出该反应的化学方程式 。
(4) 为测定滤渣中铜的质量分数,取50g的滤渣与足量的试剂A反应,得到5.6L气体(标准状况下),试计算滤渣中铜的质量分数。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年云南景洪第一中学高一上期末考试化学试卷(带解析) 题型:实验题
(I)电子工业常用30%的FeCl3。溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2。
(1)写出该反应的化学方程式 。
(2)检验溶液中Fe3+存在的试剂是
(Ⅱ)印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费。通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。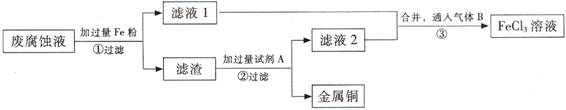 (3) 步骤①中发生反应的离子方程式
(3) 步骤①中发生反应的离子方程式
(4)滤渣的主要成分是 , (填化学式)。
(5)为了除去滤渣中的杂质得到铜,需加入的试剂A是 (填化学式)。
查看答案和解析>>
科目:高中化学 来源:2015届广东陆丰碣石中学高一下学期第一次月考化学试卷(解析版) 题型:实验题
(I) 电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2。
(1) 写出该反应的化学方程式 。
(2) 检验溶液中Fe3+存在的试剂是 ,证明Fe3+存在的现象是 。
(Ⅱ) 印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费。通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。

⑴ 步骤①中发生反应的离子方程式 。
(2) 步骤②需加入的试剂A是 (填化学式)。
(3) 步骤③通入的气体B是 (填化学式),写出该反应的化学方程式 。
(4) 为测定滤渣中铜的质量分数,取50g的滤渣与足量的试剂A反应,得到5.6L气体(标准状况下),试计算滤渣中铜的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
(I)电子工业常用30%的FeCl3。溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2。
(1)写出该反应的化学方程式 。
(2)检验溶液中Fe3+存在的试剂是
证明Fe2+存在的现象是 。
(Ⅱ)印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费。通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3 溶液,作为腐蚀液原料循环使用。

(3) 步骤①中发生反应的离子方
(4)滤渣的主要成分是 (填化学式)。
(5)为了除去滤渣中的杂质得到铜,需加入的试剂A是 (填化学式)。
(6)步骤③通人的气体B (填化学式),
写出该反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com