
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)下图是在101kPa,298k条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中能量变化示意图。

已知:① N2(g)+O2(g)=2NO(g) △H=+179.5kJ/mol
② 2NO(g)+O2(g)=2NO2(g) △H=-112.3kJ/mol
则在298k时,反应:2NO(g)+2CO(g) N2(g)+2CO2(g)的△H=
。
N2(g)+2CO2(g)的△H=
。
(2)将0.20mol NO2和0.10molCO充入一个容积恒定为1L的密闭容器中发生反应,在不同条件下,反应过程中部分物质的浓度变化状况如图所示。

①下列说法正确的是 。(填序号)
a.容器内的压强不发生变化说明该反应达到平衡
b.当向容器中加再充入0.20mol NO时,平衡向正反应方向移动,K值增大
c.升高温度后,K值减小,NO2的转化率减小
d.向该容器内充入He气,反应物的体积减小,浓度增大,所以反应反应速率增大
②计算产物NO在0~2min时平均反应速率v(NO)= mol·L-1·min-1;
③第4min时改变的反应条件为 (填“升温”、“降温”);
④计算反应在第6min时的平衡常数K= 。若保持温度不变,此时再向容器中充入CO、NO各0.060mol,平衡将 移动(填“正向”、“逆向”或“不”)。
(3)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。其负极的反应式为 ,当有0.25molSO2被吸收,则通过质子(H+)交换膜的H+的物质的量为 。

(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其KSP=2.8×10-9mol2/L2。现将2×10-4mol/L的Na2CO3溶液与一定浓度的CaC12溶液等体积混合生成沉淀,计算应加入CaC12溶液的最小浓度为 。
(16分)(1)-759.8kJ/mol (2分) (2)①C (2分) ②0.015 (2分) ③升温 (2分)
④1/36 (2分) 逆向 (1分) (3)SO2+2H2O-2e-=SO42-+4H+ (2分) 0.5mol (2分)
(4)5.6×10-5mol/L (2分)
【解析】
试题分析:(1)根据图像可知,反应物的总能量高于生成物的总能量,因此该反应是放热反应,其反应热△H=134kJ/mol-368kJ/mol=-234kJ/mol,即热化学方程式是③ NO2(g)+CO(g) CO2(g)+NO(g)
△H=-234kJ/mol。根据盖斯定律可知,②-①+③×2即得到反应2NO(g)+2CO(g)
CO2(g)+NO(g)
△H=-234kJ/mol。根据盖斯定律可知,②-①+③×2即得到反应2NO(g)+2CO(g) N2(g)+2CO2(g),因此该反应的反应热△H=-112.3kJ/mol-179.5kJ/mol-234kJ/mol×2=-759.8kJ/mol。
N2(g)+2CO2(g),因此该反应的反应热△H=-112.3kJ/mol-179.5kJ/mol-234kJ/mol×2=-759.8kJ/mol。
(2)①根据反应NO2(g)+CO(g) CO2(g)+NO(g)
△H=-234kJ/mol可知,该反应是体积不变的、放热的可逆反应,则:
CO2(g)+NO(g)
△H=-234kJ/mol可知,该反应是体积不变的、放热的可逆反应,则:
a.反应前后体积不变,则压强始终是不变的,所以容器内的压强不发生变化,不能说明该反应达到平衡,a不正确;
b.平衡常数只与温度有关系,当向容器中加再充入0.20mol NO时,平衡向逆反应方向移动,K值不变,b不正确;
c.升高温度后,平衡向逆反应方向移动,因此K值减小,NO2的转化率减小,c正确;
d.向该容器内充入He气,容器容积不变,反应物的浓度不变,所以反应反应速率不变,d不正确 ,答案选c。
②根据图像可知,在0~2min内NO的浓度增加了0.03mol/L,则根据方程式可知,NO2的浓度就减少0.03mol/L,所以产物NO在0~2min时平均反应速率v(NO)=0.03mol/L÷2=0.015mol·L-1·min-1。
③根据图像可知,在4min时反应物的浓度增加,而生成物的浓度降低,这说明反应向逆反应方向移动。由于正反应是放热反应,因此改变的条件是升高温度。
④根据图像可知,6min时反应重新建立平衡状态。此时NO和CO2的浓度均是0.02mol/L,NO2和CO的浓度分别是0.18mol/L和0.08mol/L,因此反应在第6min时的平衡常数K= =
= =
= ;若保持温度不变,此时再向容器中充入CO、NO各0.060mol,则此时
;若保持温度不变,此时再向容器中充入CO、NO各0.060mol,则此时 =
= =
= >
> ,因此平衡逆向进行。
,因此平衡逆向进行。
(3)原电池中负极失去电子,所以SO2在负极通入,其电极反应式是SO2+2H2O-2e-=SO42-+4H+;当有0.25molSO2被吸收,则负极生成1.0mol氢离子和0.25mol SO42-,所以要保持电荷守恒,需要将左侧多余的0.5mol氢离子通过质子(H+)交换膜交换到右侧。
(4)设应加入CaC12溶液的最小浓度为x,则混合后c(Ca2+)=0.5x,c(CO32-)=1×10-4mol/L。根据碳酸钙的溶度积常数可知,混合要生成沉淀,则0.5x×1×10-4mol/L ≥2.8×10-9mol2/L2,解得x≥5.6×10-5mol/L。
考点:考查反应热、反应速率、平衡常数以及溶度积常数的有关计算;外界条件对平衡状态的影响;平衡常数以及原电池原理的应用等


科目:高中化学 来源: 题型:阅读理解

| c(N2)?c2(CO2) |
| c2(CO)?c2(NO) |
| c(N2)?c2(CO2) |
| c2(CO)?c2(NO) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 充电 |
| 放电 |
| c(N2)c2(CO2) |
| c2(NO)c2(CO) |
| c(N2)c2(CO2) |
| c2(NO)c2(CO) |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
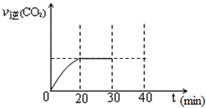 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.浓度/mol?L-1 时间/min |
NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河北省邯郸市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
随着大气污染的日趋严重,国家拟于“十二”五期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g) =4NO(g) + CO2(g) +2H2O(g)??? ⊿H= -574 kJ·mol-1
②CH4(g) +4NO(g) =2N2(g) + CO2(g) + 2H2O(g)??? ⊿H= -1160 kJ·mol-1
③H2O(g) = H2O(l)???? △H= -44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2 (g)、CO2 (g)和H2O(1)的热化学方程式?????????? 。
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为????????????????????????????????? 。
??? 浓度/mol·L-1
| NO | N2 | CO2 |
0 | 1.00 | 0 | 0 |
10 | 0.58 | 0.21 | 0.21 |
20 | 0.40 | 0.30 | 0.30 |
30 | 0.40 | 0.30 | 0.30 |
40 | 0.32 | 0.34 | 0.17 |
50 | 0.32 | 0.34 | 0.17 |
(3)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2 (g)+CO2 (g) 。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g)+CO2 (g) 。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①10min~20min以v(CO2) 表示的平均反应速率为 ?????????????????????? 。
②根据表中数据,计算T1℃时该反应的平衡常数为??? ??? (保留两位小数)。
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率?????? (填“增大”、“不变”或“减小”) 。
④下列各项能作为判断该反应达到平衡的是 (填序号字母)。
A.容器内压强保持不变
B.2v正(NO) = v逆(N2)
C.容器内CO2的体积分数不变
D.混合气体的密度保持不变
⑤30min末改变某一条件,过一段时间反应重新达到平衡,则改变的条件可能是?????????? 。请在图中画出30min至40min 的变化曲线。

查看答案和解析>>
科目:高中化学 来源:2013-2014学年吉林省白山市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
(15分)随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g) + CO2(g) +2H2O(g) ⊿H= -574 kJ·mol-1
②CH4(g) +4NO(g)=2N2(g) + CO2(g) + 2H2O(g) ⊿H=-1160 kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2 (g)、CO2 (g)和H2O(1)的热化学方程式 。
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为 。
(3)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2(g)。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
|
浓度/mol·L-1
|
NO |
N2 |
CO2 |
|
0 |
1.00 |
0 |
0 |
|
10 |
0.58 |
0.21 |
0.21 |
|
20 |
0.40 |
0.30 |
0.30 |
|
30 |
0.40 |
0.30 |
0.30 |
|
40 |
0.32 |
0.34 |
0.17 |
|
50 |
0.32 |
0.34 |
0.17 |
①10min~20min以v(CO2) 表示的反应速率为 。
②根据表中数据,计算T1℃时该反应的平衡常数为 (保留两位小数)。
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率 (填“增大”、“不变”或“减小”) 。
④下列各项能作为判断该反应达到平衡的是 (填序号字母)。
A.容器内压强保持不变 B.2v正(NO)=v逆(N2)
C.容器内CO2的体积分数不变 D.混合气体的密度保持不变
⑤30min末改变某一条件,过一段时间反应重新达到平衡,则改变的条件可能是 。请在右图中画出30min至40min 的变化曲线。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com