
| A. | 将颗粒状锶单质放入水中,反应剧烈,生成大量的气体,气体燃烧且发生轻微爆炸 | |
| B. | 颗粒状锶单质与稀硫酸反应,反应现象不如钠与水反应剧烈 | |
| C. | 锶在纯氧中可以燃烧,燃烧产物与水反应生成的氢氧化物为强碱 | |
| D. | 锶在纯净氮气中可以燃烧,燃烧产物与水反应可以放出气体 |
分析 第ⅡA族元素有铍、镁、钙、锶、钡、镭,同主族元素从上到下金属性逐渐增强,金属性越强,其单质与水反应越剧烈,其最高价氧化物的水化物的碱性越强;锶在纯净氮气中可以燃烧生成氮化锶,氮化锶与水反应生成氨气,据此分析.
解答 解:A.锶的活泼性大于钙,所以与水反应更剧烈,则将颗粒状锶单质放入水中,反应剧烈,生成大量的气体,气体燃烧且发生轻微爆炸,故A正确;
B.金属的活泼性:Sr>Ca>Na,则颗粒状锶单质与稀硫酸反应,反应现象比钠与水反应剧烈,故B错误;
C.锶的最高价氧化物的水化物为强碱,则锶在纯氧中可以燃烧,燃烧产物与水反应生成的氢氧化物为强碱,故C正确;
D.锶在纯净氮气中可以燃烧生成氮化锶,氮化锶与水反应生成氨气,所以锶在氮气中燃烧产物与水反应可以放出气体,故D正确.
故选B.
点评 本题考查了元素周期律,侧重于同主族元素性质的考查,注意把握同主族元素性质的变化规律,题目难度不大.


科目:高中化学 来源: 题型:填空题
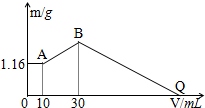 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的悬浊液中逐滴加入1mol/LHCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如图所示.试回答:
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的悬浊液中逐滴加入1mol/LHCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如图所示.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
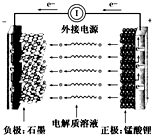 通常氢氧燃料电池有酸式和碱式两种,试回答下列问题:
通常氢氧燃料电池有酸式和碱式两种,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铜片作正极,锌片作负极 | |
| B. | 该电池工作时,锌失电子变为Zn2+进入溶液 | |
| C. | 该电池工作时,电子由锌片流向铜片 | |
| D. | 该电池工作时,H+在锌片上得电子被还原生成H2逸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①③⑤ | C. | ①②③ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可通过控制溶液的pH降低氨基酸的熔点,分离不同氨基酸 | |
| B. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色 | |
| C. | 所有的糖类、油脂和蛋白质均能发生水解反应 | |
| D. | 利用二氧化碳制造全降解塑料能有效减少“白色污染” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 除去乙烷中混有的乙烯,加氯气光照 | |
| B. | 除去乙烯中混有的水蒸气,通过盛有浓硫酸的洗气瓶 | |
| C. | 除去乙烷中混有水蒸气,通过碱石灰的干燥管 | |
| D. | 除去乙烯中混有的少量SO2,通过KMnO4酸性溶液后再干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com