
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | C2H4 | C3H8 | C4H8 | C5H12 | C7H16 | C8H16 |
| A. | 13 | B. | 14 | C. | 10 | D. | 9 |
分析 根据表格中物质的化学式的规律,可知7号物质为C6H12.
同分异构体的书写方法:
1.主链由长到短,短至主链碳原子数目不得少于或等于全部碳原子数的二分之一.
2.支链的大小由整到散.
3.支链的位置由“心”到“边”(末端碳原子除外).
4.支链的排布由相“对”,相“邻”到相“间”.
解答 解:根据表格中物质的化学式的规律,可知7号物质为C6H12的链状烃,即是在己烷C6H14的碳链上按碳碳双键.
由于己烷C6H14的碳链异构有五种:
①主链为6个碳原子时:CH3CH2CH2CH2CH2CH3,则此碳链结构的C6H12的同分异构体有三种:CH2=CHCH2CH2CH2CH3,CH3CH=CHCH2CH2CH3,CH3CH2CH=CHCH2CH3;
②主链为5个碳原子时:(CH3)2CHCH2CH2CH3、CH3CH2CH(CH3)CH2CH3,则和(CH3)2CHCH2CH2CH3碳链结构相同的C6H12的同分异构体有四种:CH2=C(CH3)CH2CH2CH3、(CH3)2C=CHCH2CH3、(CH3)2CHCH=CHCH3、(CH3)2CHCH2CH=CH2;
则和CH3CH2CH(CH3)CH2CH3碳链结构相同的C6H12的同分异构体有三种:CH2=CH2CH(CH3)CH2CH3、CH3CH=C(CH3)CH2CH3、CH3CH2C=(CH2)CH2CH3;
③主链为4个碳原子时:(CH3)2CHCH(CH3)2、(CH3)3CCH2CH3 ;则和(CH3)2CHCH(CH3)2碳链结构相同的C6H12的同分异构体有2种:(CH3)2C=C(CH3)2、CH2=C(CH3)CH(CH3)2;
则和(CH3)3CCH2CH3 碳链结构相同的C6H12的同分异构体有1种:(CH3)3CCH=CH2 .
故C6H12的链状同分异构体共13种.
故选A.
点评 本题主要考查了同分异构体的书写,注意减链法的掌握与使用,并应注意先书写碳链异构,再书写位置异构.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:解答题
| 序号 | 反应温度/℃ | c(H2O2)/mol•L-1 | V(H2O2)/mL | m(MnO2)/g | t/min |
| 1 | 20 | 2 | 10 | 0 | t1 |
| 2 | 20 | 2 | 10 | 0.1 | t2 |
| 3 | 20 | 4 | 10 | 0.1 | t3 |
| 4 | 40 | 2 | 10 | 0.1 | t4 |
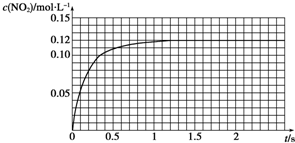
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 N和Si是合成新型非金属材料的两种重要元素.请回答:
N和Si是合成新型非金属材料的两种重要元素.请回答: ;Si原子可形成多种氢化物,其中Si2H6中Si原子的价层电子对数目为4.
;Si原子可形成多种氢化物,其中Si2H6中Si原子的价层电子对数目为4.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
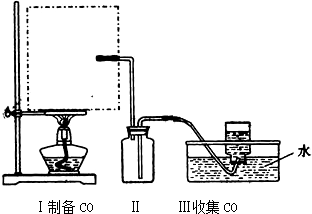
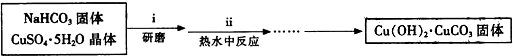
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置 | 现象 |
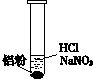 | ⅰ.实验初始,未见明显现象 ⅱ.过一会儿,出现气泡,液面上方呈浅棕色 ⅲ.试管变热,溶液沸腾 |
| 实 验 | 内 容 | 现 象 |
| 实验1 | 将湿润KI-淀粉试纸置于空气中 | 未变蓝 |
| 实验2 | 用湿润KI-淀粉试纸检验浅棕色气体 | 试纸变蓝 |
| 装置 | 现象 |
 | ⅰ.实验初始,未见明显现象 ⅱ.过一会儿,出现气泡,有刺激性气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | ||
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 | ||
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||||
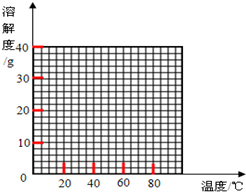
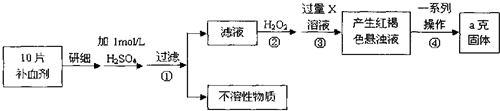
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com