
【题目】已知盐酸是强酸,在下列叙述中,能说明醋酸是弱酸的是
A.将pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入水的量少
B.盐酸和醋酸都可用相应的钠盐与同浓度硫酸反应制取
C.相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH变大
D.相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等
【答案】C
【解析】
试题分析:A.pH=4的盐酸和醋酸,氢离子浓度都是0.0001mol/L,稀释成pH=5的溶液,醋酸是弱酸,醋酸所需加入的水量多,故A错误;B.盐酸和醋酸都可用相应的钠盐与同浓度硫酸反应制取盐酸是利用盐酸的挥发性,与酸性强弱无关,故B错误;C.在醋酸的溶液中存在着CH3COOH ![]() CH3COO-+H+的电离平衡,CH3COONa溶于水后,电离出大量CH3COO-离子,使醋酸的电离平衡向生成醋酸的方向移动,抑制了CH3COOH的电离,使c(H+)减小,因此溶液的pH增大.由此证明盐酸为强酸,醋酸为弱酸,故C正确;D.相同pH,则氢离子浓度相同,产生氢气的起始速率相等,与盐酸是强酸,醋酸是弱酸无关,故D错误;故选C。
CH3COO-+H+的电离平衡,CH3COONa溶于水后,电离出大量CH3COO-离子,使醋酸的电离平衡向生成醋酸的方向移动,抑制了CH3COOH的电离,使c(H+)减小,因此溶液的pH增大.由此证明盐酸为强酸,醋酸为弱酸,故C正确;D.相同pH,则氢离子浓度相同,产生氢气的起始速率相等,与盐酸是强酸,醋酸是弱酸无关,故D错误;故选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如图所示关系,根据图示转化关系推测下列说法不正确的是

A. 可用KI淀粉试纸和食醋检验加碘盐中是否含有碘
B. 足量Cl2能使湿润的KI淀粉试纸变白的原因可能是5Cl2+I2+6H2O==2HIO3+10HCl
C. 由图可知氧化性的强弱顺序为Cl2>I2>IO3-
D. 途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料。下列说法正确的是( )
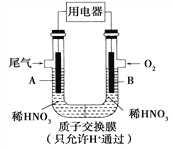
A. 电解质溶液中电流的方向由B到A,电子的流向与之相反
B. 电极A表面反应之一为NO-3e-+2H2O===NO![]() +4H+
+4H+
C. 电极B附近的c(NO![]() )增大
)增大
D. 该电池工作时,每转移4 mol电子,生成22.4 L O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学键及化合物的分类完全正确的一组是
A. MgCl2与NaOH均既含离子键又含共价键,均属离子化合物
B. BaCO3与H2SO4化学键类型不完全相同,均属强电解质
C. 乙醇与醋酸,均只含共价键,均属非电解质
D. 氯气与氧气,均只含共价键,均只做氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017新课标Ⅰ节选]下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为____________________________、____________________________,制得等量H2所需能量较少的是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室在配制氯化铁溶液时,先把氯化铁晶体溶解在稀盐酸中,再加水稀释所需浓度,如此操作的目的是
A.防止氯化铁电离B.抑制氯化铁水解
C.提高溶液的pHD.提高氯化铁的溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500 mL有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀.则原混合溶液中钾离子物质的量浓度为( )
A. 0.1(b-2a)mol/L B. 10(2a-b)mol/L
C. 10(b-a)mol/L D. 10(b-2a)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T1、T2两种温度下BaSO4在水中的沉淀溶解平衡曲线如图所示,请回答下列问题:

(1)T1____(填“>”、“<”或“=”)T2,T2时Ksp(BaSO4)=________。
(2)根据T1温度时BaSO4的沉淀溶解平衡曲线,判断下列说法正确的是________(填序号)。
A.加入Na2SO4可由a点变为b点
B.在T1曲线上方区域(不含曲线)的任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能由d点变为T1曲线上a、b之间的某一点(不含a、b)
D.升温可由b点变为d点
(3)沉淀的生成、溶解和转化在无机物制备和提纯及科研等领域有着广泛应用。已知25 ℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9。
①医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂。胃酸很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是__________________(用沉淀溶解平衡原理解释)。万一误服了少量BaCl2,应尽快用大量0.5 mol·L-1 Na2SO4溶液洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为________ mol·L-1。
②长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。CaSO4转化为CaCO3的离子方程式为____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com