
【题目】将0.6mol KCl、0.4mol Cu(NO3)2、0.2molAgNO3一起溶于水,配成100mL混合溶液,用惰性电极电解一段时间后,若在一极析出19.2g Cu,此时在另一极上产生气体的体积(标准状况下)为
A.3.96LB.4.48LC.5.6LD.6.72L
【答案】C
【解析】
混合溶液中发生的反应为AgNO3+ KCl =AgCl↓+KNO3,得混合溶液中的溶质为0.2molKNO3、0.4molCu(NO3)2、0.4molKCl,根据Cu和转移电子之间的关系式可计算出O2和Cl2的体积。
混合溶液中发生的反应为AgNO3+ KCl =AgCl↓+KNO3,根据方程式知,0.2mol AgNO3完全反应需要0.2molKCl,还剩余0.4molKCl,且同时生成0.2molKNO3,所以混合溶液中的溶质为0.2molKNO3、0.4molCu(NO3)2、0.4molKCl,用惰性电极电解一段时间后,若在一极析出Cu:0.3mol(19.2g)<0.4mol,根据Cu和转移电子之间的关系式知,转移电子的物质的量=2n(Cu)=2×0.3mol=0.6mol,氯离子完全放电时转移电子物质的量=0.4mol×1=0.4mol,则还有0.2mol电子转移时生成氧气,则生成n(O2)=![]() =0.05mol,生成n(Cl2)=
=0.05mol,生成n(Cl2)=![]() n(Cl-)=
n(Cl-)= ![]() ×0.4mol=0.2mol,生成气体V=nVm=(0.2+0.05)mol×22.4mol/L=5.6L,
×0.4mol=0.2mol,生成气体V=nVm=(0.2+0.05)mol×22.4mol/L=5.6L,
故选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )
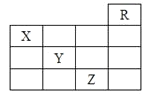
①X的气态氢化物与Y的最高价氧化物对应的水化物能发生反应生成盐;
②Y、Z的气态氢化物水溶液的酸性Y<Z;
③Z的单质常温下是液体,可与铁粉反应;
④Z的原子序数比Y大19;
⑤Z所在的周期中含有32种元素
A.①②③④B.①②③④⑤C.只有③D.只有①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业生产流程制备无水FeCl3,实验装置如下图所示:
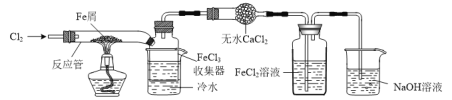
已知:无水FeCl3在空气中易潮解,加热易升华。
⑴通入Cl2和加热反应管这两步操作的先后顺序是_____,原因是______。
⑵实验后生成的FeCl3大部分进入收集器,少量沉积在反应管的右端。要使沉积得FeCl3进入收集器,可以进行的操作是________。
⑶洗气瓶中的FeCl2溶液用于吸收未反应的Cl2。向反应后的洗气瓶中滴加KSCN溶液,结果看到溶液先变红后褪色,溶液褪色的可能原因是_______。
⑷洗气瓶中生成的FeCl3溶液可用于吸收H2S气体生成S。写出吸收H2S气体的离子反应方程式:_______。为检测反应后溶液中是否存在Fe2+,甲同学提出可用酸性KMnO4溶液,乙同学提出酸性KMnO4溶液褪色不能证明存在Fe2+,理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是国际公认高效、安全的杀菌、保鲜剂,是氯制剂的理想替代品。工业上制备ClO2的方法很多,NaClO3 和NaClO2是制取ClO2的常见原料。完成下列填空:
(1)以下反应是制备ClO2的一种方法:H2C2O4+2NaClO3+H2SO4→Na2SO4+2CO2↑+2ClO2↑+2H2O
上述反应物中属于第三周期元素的原子半径大小顺序是___;其中原子半径最大元素的原子,其核外电子排布式为___,其核外有___种不同能量的电子。
(2)ClO2的分子构型为“V”形,则ClO2是___(选填“极性”、“非极性”)分子,其在水中的溶解度比氯气___(选填“大”、“小”、“一样”)。
(3)ClO2具有强氧化性,若ClO2和Cl2在消毒时自身均被还原为Cl-,ClO2的消毒能力是等质量Cl2的___倍(保留2位小数)。
(4)若以NaClO2为原料制取ClO2,需要加入具有___(填“氧化”、“还原”)性的物质。
(5)工业上制取NaClO3通过电解法进行,电解时,不同反应环境下的总反应分别为:
4NaCl +18H2O→4NaClO3+3O2↑+18H2↑(中性环境)
NaCl +3H2O→NaClO3 +3H2↑(微酸性环境)
①电解时,氢气在___极产生。
②更有利于工业生产NaClO3的反应环境是___,理由__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是一种医用高分子材料,可用于制造隐形眼镜;以下是M、有机玻璃的原料H及合成橡胶(N)的合成路线。
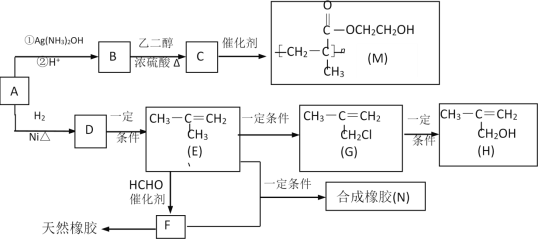
(1)A中含有的官能团是___(写名称)。
(2)写出反应类型:D→E___;写出反应条件:G→H___。
(3)写出B→C化学反应方程式:___;
(4)写出E+F→N化学反应方程式:___。
(5)H在一定条件下能被氧化为不饱和酸![]() ,该不饱和酸有多种同分异构体,属于酯类且含有碳碳双键的同分异构体共有___种。
,该不饱和酸有多种同分异构体,属于酯类且含有碳碳双键的同分异构体共有___种。
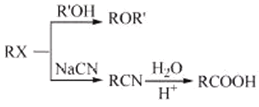
(6)已知:①RCHO![]()
![]()
②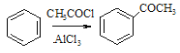
③![]() +SOCl2
+SOCl2![]() +SO2+HCl
+SO2+HCl
根据已有知识并结合相关信息,写出以 为原料制备
为原料制备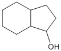 的合成路线流程图(无机试剂任用)___。合成路线流程图示例如下:H2C=CH2
的合成路线流程图(无机试剂任用)___。合成路线流程图示例如下:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH。
CH3CH2OH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究金属与硝酸的反应,实验如下。
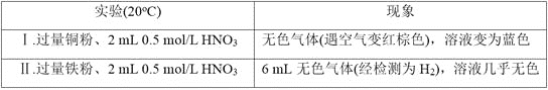
(1)Ⅰ中的无色气体是_________。
(2)Ⅱ中生成H2的离子方程式是______________。
(3)研究Ⅱ中的氧化剂
①甲同学认为该浓度的硝酸中H+的氧化性大于![]() ,所以
,所以![]() 没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法不正确,其实验证据是____________。
没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法不正确,其实验证据是____________。
②乙同学通过分析,推测出![]() 也能被还原,依据是_____________,进而他通过实验证实该溶液中含有
也能被还原,依据是_____________,进而他通过实验证实该溶液中含有![]() ,其实验操作是____________。
,其实验操作是____________。
(4)根据实验,金属与硝酸反应时,影响硝酸还原产物不同的因素有__________;试推测还可能有哪些因素影响_________(列举1条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于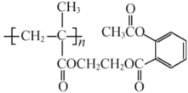 的说法,正确的是( )
的说法,正确的是( )
A.该物质可由n个单体分子通过缩聚反应生成
B.![]() 该物质完全燃烧,生成33.6 L(标准状况)的
该物质完全燃烧,生成33.6 L(标准状况)的![]()
C.该物质在酸性条件下水解产物之一可作汽车发动机的抗冻剂
D.![]() 该物质与足量
该物质与足量![]() 溶液反应,最多可消耗
溶液反应,最多可消耗![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应的微观示意图如图所示,下列说法错误的是
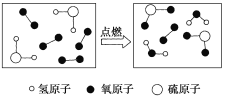
A.反应物中有单质
B.生成物均是氧化物
C.反应前是混合物,反应后是纯净物
D.化学方程式是2H2S+3O2![]() 2SO2+2H2O
2SO2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以芳香族化合物A为起始原料,按下列路线合成高血压药物阿替洛尔。
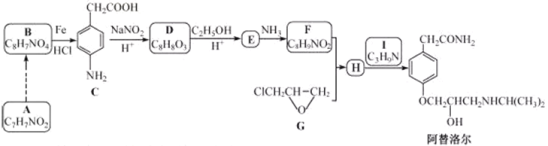
已知:化合物H中除了苯环还有其它环
 :
:![]()
请回答:
(1)下列说法正确的是________。
A.化合物D能发生加成,取代,氧化反应,不发生还原反应
B.化合物E能与![]() 溶液发生显色反应
溶液发生显色反应
C.化合物1具有弱碱性
D.阿替洛尔的分子式是![]()
(2)写出化合物E的结构简式________。
(3)写出![]() 的化学方程式________。
的化学方程式________。
(4)设计从A到B的合成路线(用流程图表示,无机试剂任选)________。
(5)写出化合物C同时符合下列条件的同分异构体的结构简式________。
①![]() 谱和IR谱检测表明:分子中共有4种氢原子,无氮氧键和碳氮双键;
谱和IR谱检测表明:分子中共有4种氢原子,无氮氧键和碳氮双键;
②除了苯环外无其他环。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com