
主族元素原子失去最外层电子形成阳离子,主族元素的原子得到电子填充在最外层形成阴离子,下列各原子或离子的电子排布式错误的是( )
A、Ca2+ 1s22s22p63s23p6 B、O 1s22s23p4
C、Cl- 1s22s22p63s23p6 D、A r 1s22s22p63s23p6
科目:高中化学 来源: 题型:
| A、同一周期元素的原子,半径越小越容易失去电子 | B、ⅠA族元素的金属性比ⅡA族元素的金属性强 | C、若M+和R2-的核外电子层结构相同,则原子序数:R>M | D、主族元素的最高正化合价等于该元素原子的最外层电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学三轮复习排查 专题14物质结构与性质选修3练习卷(解析版) 题型:填空题
图示法和图像法都是常用的科学研究方法。
(1)科学家通过X射线推测胆矾中既含有配位键又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示。
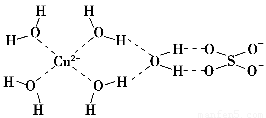
①写出基态Cu原子的核外电子排布式________________________________。
②写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来)________。
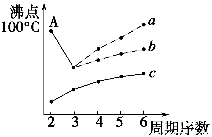
(2)下图是研究部分元素氢化物的沸点变化规律的图像,折线c可以表达出第________族元素氢化物的沸点变化规律。两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b,你认为正确的是________(填“a”或“b”),理由是______________________________________________________________。
(3)第三周期元素的气态电中性基态原子失去最外层一个电子转化为气态基态正离子所需的最低能量叫做第一电离能(设为E)。如图所示:
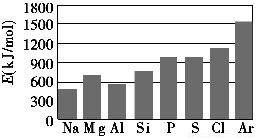
①同周期内,随着原子序数的增大,E值变化的总趋势是________;
②根据图中提供的信息,试推断E氧________E氟(填“>”、“<”或“=”,下同);
③根据第一电离能的含义和元素周期律,试推断E镁________E钙。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省泰安市高三上学期期中考试化学试卷(解析版) 题型:选择题
依据元素周期表及元素周期律,下列推断正确的是
A.同一周期元素的原子,半径越小越容易失去电子
B.ⅠA族元素的金属性比ⅡA族元素的金属性强
C.若M+和R2-的核外电子层结构相同,则原子序数R>M
D.主族元素的最高正化合价等于该元素原子的最外层电子数
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山西省高三10月月考化学试卷(解析版) 题型:填空题
(15分)原子序数依次递增的A、B、C、D、E是周期表中前30号元素。已知A的最外层电子数是其内层电子数的2倍;A与C形成的常见化合物之一是主要的温室气体;D与A同主族,其单质在同周期元素所形成的单质中熔点最高;E原子M能层为全充满状态,且核外的未成对电子只有一个。请回答下列问题:
(1)B在周期表中的位置是: ,该主族元素的气态氢化物中,沸点最低的是 (填化学式)。
(2)根据等电子原理分析,BC2 + 中B原子的轨道杂化类型是 。
(3)五种元素中,电负性最大与最小的两种非金属元素形成的化合物在常温下是晶体,其晶体类型是 。
(4)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5…,推测D元素的电离能突增应出现在第 电离能。
(5)A的一种相对分子质量为28的氢化物,其分子中σ键与π键的个数之比为 ;;
(6)E的基态原子有 种形状不同的原子轨道;E2+ 的价电子排布式为 ;下
图(填甲、乙或丙) 表示的是E晶体中微粒的堆积方式。



甲 乙 丙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com