
| Na2O2/mol | NaHCO3/mol | 气体成分 | |
| A | 1 | 2 | Na2CO3 |
| B | 1.5 | 2 | Na2O2 Na2CO3 |
| C | 2 | 1 | Na2CO3、NaOH、Na2O2 |
| D | 3 | 2 | NaOH、Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
分析 混合物在密闭容器中加热(温度高于100℃),可能发生如下反应:
①2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2,
②2Na2O2+2CO2═2Na2CO3+O2,
③2Na2O2+2H2O═4NaOH+O2,
④2NaOH+CO2═Na2CO3+H2O,
由上述反应,可得总的反应方程式为:
Ⅰ、Na2O2+2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$2Na2CO3+$\frac{1}{2}$O2↑+H2O↑
Ⅱ、2Na2O2+2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$2Na2CO3+O2↑+2NaOH
A、当x=$\frac{1}{2}$时,只发生反应Ⅰ,且二者恰好完全反应,此时剩余固体为Na2CO3,气体成分为H2O(g)、O2;
B、当$\frac{1}{2}$<x<1时,发生反应Ⅰ、Ⅱ,此时剩余固体为Na2CO3、NaOH,气体成分为H2O(g)、O2;
当x=1时,只发生反应Ⅱ,此时剩余固体为Na2CO3、NaOH,气体成分为只有O2;
C、D、当x>1时,发生反应Ⅱ,过氧化钠有剩余.
解答 解:混合物在密闭容器中加热(温度高于100℃),可能发生如下反应:
①2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2,
②2Na2O2+2CO2═2Na2CO3+O2,
③2Na2O2+2H2O═4NaOH+O2,
④2NaOH+CO2═Na2CO3+H2O,
由上述反应,可得总的反应方程式为:
Ⅰ、Na2O2+2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$2Na2CO3+$\frac{1}{2}$O2↑+H2O↑
Ⅱ、2Na2O2+2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$2Na2CO3+O2↑+2NaOH
A、当x=$\frac{1}{2}$时,只发生反应Ⅰ,且二者恰好完全反应,此时剩余固体为Na2CO3,气体成分为H2O(g)、O2,故A正确;
B、当$\frac{1}{2}$<x<1时,发生反应Ⅰ、Ⅱ,此时剩余固体为Na2CO3、NaOH,气体成分为H2O(g)、O2,故B错误;
C、当x>1时,发生反应Ⅱ,过氧化钠有剩余,此时剩余固体为Na2CO3、NaOH、Na2O2,故C正确;
D、当x>1时,发生反应Ⅱ,过氧化钠有剩余,此时剩余固体为Na2CO3、NaOH、Na2O2,故D错误;
故选BD.
点评 本题考查混合物的有关计算等,难度较大,注意利用总反应方程式分段讨论,由于二氧化碳与氢氧化钠反应,故可以认为过氧化钠先与二氧化碳反应,反应完毕过氧化钠有剩余再与水反应,据此分段书写总反应式.


 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:选择题
| A. | 现代元素周期表中,元素按照元素的相对原子质量递增顺序排列 | |
| B. | 最外层电子数相同的不同元素一定处于同-主族 | |
| C. | 在元素周期表中金属与非金属的分界线附近,可以找到半导体材料 | |
| D. | X2+的核外电子数目为18,则X处于笫三周期第ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
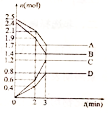 在某一容积为2 L的密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间 t(min)的变化曲线如图所示,回答下列问题:
在某一容积为2 L的密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间 t(min)的变化曲线如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有硫酸铜水溶液的试管里,现象为开始生成蓝色沉淀,后蓝色沉淀溶解,得到深蓝色的透明溶液.
;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有硫酸铜水溶液的试管里,现象为开始生成蓝色沉淀,后蓝色沉淀溶解,得到深蓝色的透明溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属镁燃烧:化学能→热能和光能 | B. | 原电池:化学能→电能 | ||
| C. | 植物的光合作用:太阳能→热能 | D. | 太阳能热水器:光能→热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性(吸水溶液):HSCN>H2CO3>HCN | B. | 还原性(碱性溶液):Fe(OH)2>I->KIO3 | ||
| C. | 热稳定性:NaCl>NaClO4>NaClO | D. | 氧化性(酸性溶液):I2>FeCl3>Co(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com