
| A、(1)(3) |
| B、(1)(4) |
| C、(1)(3)(4) |
| D、(2)(3)(4) |
| ||
| 2s |
| ||
| 2 |
| 1.2 |
| 4 |
| 1.4mol |
| 2L |


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原混合物中n(Fe):n(Fe2O3)=2:1 |
| B、向溶液中滴入无色的KSCN溶液,显血红色 |
| C、无法计算出原混合物的质量 |
| D、此时溶液中Fe2+和Fe3+的物质的量之比为3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )| A、图中AB段的氧化剂为K2Cr2O7 |
| B、图中BC段发生的反应为2Fe3++2I-=2Fe2++I2 |
| C、开始加入的K2Cr2O7为0.25 mol |
| D、K2Cr2O7可与FeSO4反应的物质的量为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶液组成主要成分 | 对应图象 | 溶液中离子浓度关系 | |
| A | NaHCO3 | 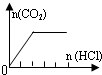 | c(Na+)=c(HCO3-) |
| B | NaHCO3、Na2CO3 | 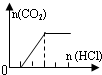 | c(CO32-)<c(HCO3-) |
| C | NaOH、Na2CO3 | 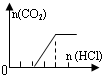 | c(OH-)>c(CO32-) |
| D | Na2CO3 | 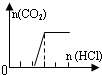 | c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①中氢氧化钠溶液较大,②中盐酸较大 |
| B、①中氨水较大,②中盐酸较大 |
| C、①中氨水较大,②中醋酸较大 |
| D、①中氢氧化钠溶液较大,②中醋酸较大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、B>A>D>C |
| B、A>B>D>C |
| C、B>A>C>D |
| D、C>D>A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时,硫作负极,电极反应式为:xS+2e-=Sx2- |
| B、放电时,电池中消耗4.6g Na,反应中转移1.204×1023个电子 |
| C、该反应一定是一个自发进行的吸热反应 |
| D、放电时,电子从钠极经外电路流向到硫极,再从硫极经内电路流向钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com