


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、熔点比铁铝合金小 |
| B、在冷、浓HNO3中可以钝化 |
| C、在空气中放置容易生锈,进而被腐蚀 |
| D、当它与铁的粉碎粒度相同时,与4mol/L盐酸反应速率比纯铁大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气体摩尔体积是指1mol任何气体所占的体积约为22.4L |
| B、一定温度和压强下,各种气态物质所占体积的大小,由构成气体的分子数决定 |
| C、不同的气体,若体积不同,则它们所含的分子数也不同 |
| D、一定温度和压强下,各种气态物质所占体积的大小,由构成气体的分子大小决定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C的最高价氧化物对应的水化物的酸性最强 |
| B、最简单气态氢化物的稳定性E>D>B |
| C、A与B形成的化合物在反应中只能作还原剂 |
| D、A分别与其他四种元素形成的化合物一定是共价化台物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
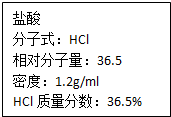 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
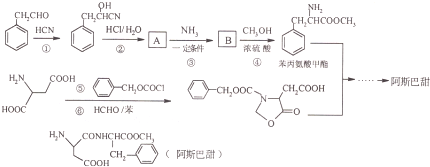
| H+/H2O |

 的合成路线流程(无机试剂任选).合成路线流程示例如下
的合成路线流程(无机试剂任选).合成路线流程示例如下 :
:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com