
某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品加入足量水仍有部分固体未溶【解析】
再加入足量稀盐酸,有气泡产生,固体全部溶解;
②取少量样品加入足量稀硫酸有气泡产生,震荡后仍有固体存在.
该白色粉末可能为( )
A.NaHCO3、Al(OH)3 B.AgCl、NaHCO3 C.Na2SO3、BaCO3 D.Na2CO3、CuSO4
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源:2017届江西省高三上第一次月考(开学考试)化学(解析版) 题型:填空题
(6分)常温下A和B两种气体组成混合物气体(A的相对分子质量大于B的相对分子质量),经分析,混合气体中只含有氮和氢两种元素;而且,不论A和B以何种比例混合,氮和氢的质量比总大于14/3。由此可确定A为_____,B为_________。其理由是_________。若上述混合气体中氮和氢的质量比为7:1,则在混合气体中A和B的物质的量之比为_________;A在混合气体中的体积分数为________%。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三入学考试理综化学试卷(解析版) 题型:填空题
【化学-选修3:物质结构与性质】(15分)
铁、铜及其化合物在日常生产、生活有着广泛的应用。请回答下列问题:
(1)铁在元素周期表中的位置是_________。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于_______(填晶体类型)。Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_______;Fe(CO)x在一定条件下发生反应:Fe(CO)x(s) Fe(s)+xCO(g)。已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型为_________。
Fe(s)+xCO(g)。已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型为_________。
(3)写出CO的一种常见等电子体分子的结构式_______;两者相比较沸点较高的为_____(填化学式)。CN-中碳原子杂化轨道类型为_______,C、N、O三元素的第一电离能最大的为____(用元素符号表示)。
(4)铜晶体中铜原子的堆积方式如图1所示。
①基态铜原子的核外电子排布式为___________。
②每个铜原子周围距离最近的铜原子数目________。
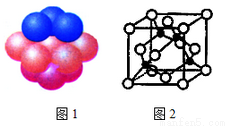
(5)M原子的价电子排布式为3s23p5,铜与M形成化合物的晶胞如图2所示(黑点代表铜原子)。
①该晶体的化学式为________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于______(填“离子”、“共价”)化合物。
③已知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为___________pm(只写计算式)。
查看答案和解析>>
科目:高中化学 来源:2017届湖南衡阳八中高三实验班暑期第一次月考理综化学(解析版) 题型:选择题
实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知Fe3+在pH=5时沉淀完全)。其中分析错误的是
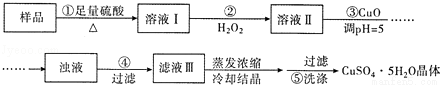
A.步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O
B.步骤②可用氯水、硝酸等强氧化剂代替H2O2
C.步骤③用 CuCO3代替CuO也可调节溶液的pH
D.步骤⑤的操作为:向漏斗中加人少量冷的蒸馏水至浸没晶体,待水自然流下,重复操作2~3次
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省大连市高二下期末化学试卷(解析版) 题型:实验题
现有一份含有FeCl3和FeCl2固体的混合物,为测定FeCl2的含量,进行如下实验:
①称取混合物样品的质量7.06g,将样品溶解
②向溶解后的溶液中,加入足量的双氧水
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀
④将沉淀过滤、洗涤后,加热灼烧,到质量不再减少,得到固体物质4.00g
根据实验回答下列问题:
(1)样品溶解过程中需加入 ,以防止 ;
(2)写出溶解后的溶液与双氧水反应的离子方程式 ;
(3)过滤操作中除用漏斗外,还需要的玻璃仪器有 ;
(4)简述检验实验步骤④中沉淀已经洗涤干净的方法 ;
(5)通过实验所得数据,计算固体样品中FeCl2的质量分数: ;
(6)实验室采用如图装置制取少量无水FeCl3固体.(已知FeCl3固体易潮解,部分夹持仪器已略去.)

该装置存在明显缺陷,得不到无水FeCl3固体,请你对该装置进行合理的改进: .
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省大连市高二下期末化学试卷(解析版) 题型:选择题
下列关于晶体的叙述中,不正确的是…( )
A.金刚石网状结构中,由共价键形成的碳原子环其中最小环有6个碳原子
B.在氯化钠的晶体中,每个Na+或Cl﹣的周围都紧邻6个Cl﹣或Na+
C.在氯化铯晶体中,每个Cs+周围都紧邻8个Cl﹣,每个Cl﹣周围也紧邻8个Cs+
D.在干冰的晶体中,每个CO2分子周围都紧邻4个CO2分子
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省大连市高二下期末化学试卷(解析版) 题型:选择题
原子序数依次增大的X、Y、Z、M、W五种短周期元素,其中X是周期表中原子半径最小的元素,Y、Z同周期,X、M同主族;X、Y、W的最外层电子数之和为12;Z的单质为空气中含量最高的成分,W的最高价和最低价代数和为6.下列说法中正确的是( )
A. 根据价层电子对互斥理论知化合物ZX3的空间构型为三角锥形
B. Y的电负性比Z的电负性强
C. W的氧化物对应的水化物一定是强酸
D. 原子半径:W>M>Z>Y
查看答案和解析>>
科目:高中化学 来源:2017届河北沧州市高三上学期第一次月考化学试卷(解析版) 题型:选择题
对反应A+B=AB来说,常温下按以下情况进行反应:
①20mL溶液中含A、B各0.01mol ②50mL溶液中含A、B各0.05mol
③0.1mol•L-1的A、B溶液各10mL ④0.5mol•L-1的A、B溶液各50mL
四者反应速率的大小关系是
A.②>①>④>③ B.④>③>②>①
C.①>②>④>③ D.①>②>③>④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省高二下学期期末化学卷(解析版) 题型:选择题
根据如表数据,则与HClO3比,HClO具有的是( )
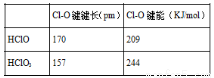
A. 更高的沸点 B. 更强的酸性
C. Cl-O断裂放出的能量更少 D. 更易放出原子氧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com