
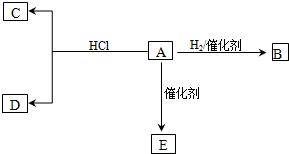
 如图所示实验装置可用于制取乙炔.
如图所示实验装置可用于制取乙炔.分析 (1)通过图中A管,可以控制反应的开始和停止;实验室通过电石与水的反应制取乙炔;
(2)乙炔能使酸性高锰酸钾溶液褪色,发生了氧化反应;
(3)关键乙炔与溴发生加成反应进行判断;
(4)乙炔是可燃性气体,可燃性气体在点燃前必须检验其纯度,以免发生爆炸;因乙炔中含碳的质量分数较大,在燃烧时火焰明亮并伴有浓烈的黑烟.
解答 解:(1)图示装置可通过调节A管的高度,控制反应的发生和停止:将A管提高,右管中水面上升,与电石接触发生反应;将A管降低,右管中水面下降,水与电石脱离接触,反应停止,则制取乙炔的化学反应方程式为CaC2+2H2O→Ca(OH)2+CH≡CH↑,
故答案为:调节水面的高度来控制反应的发生和停止;CaC2+2H2O→Ca(OH)2+CH≡CH↑;
(2)乙炔容易被高锰酸钾氧化,使高锰酸钾褪色,
故答案为:高锰酸钾溶液褪色;氧化;
(3)乙炔能够和溴水发生加成反应,导致溴的四氯化碳溶液褪色,
故答案为:溴的四氯化碳溶液褪色;
(4)乙炔燃烧的化学方程式为 2CH≡CH+5O2 $\stackrel{点燃}{→}$4CO2+2H2O;乙炔中含碳的质量分数较大,燃烧时火焰明亮并伴有浓烈的黑烟;乙炔点燃前必须检验其纯度,
故答案为:检查乙炔的纯度;明亮火焰并伴有浓烈的黑烟.
点评 本题考查乙炔的制取及化学性质、常见物质的制备方法,为高频考点,题目难度中等,注意掌握常见有机物的结构和性质.


科目:高中化学 来源: 题型:选择题
 常温下,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/L的NaOH溶液,所得溶液PH与NaOH溶液体积的关系曲线如图所示,下列说法正确的是( )
常温下,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/L的NaOH溶液,所得溶液PH与NaOH溶液体积的关系曲线如图所示,下列说法正确的是( )| A. | a、b、c、d四个点中,水的电离程度最大的是d | |
| B. | a点溶液中:c(NH3•H2O)+c(H+)═c(OH-) | |
| C. | b点溶液中:c(Na+)+c(NH4+)═2c(SO42-) | |
| D. | c点溶液中:c(Na+)═c(SO42-)+c(NH4+)+c(NH3•H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与氯气混和后光照反应;乙烯使酸性高锰酸钾溶液的褪色 | |
| B. | 乙烯与溴的四氯化碳溶液反应;苯与氢气在一定条件下反应生成环己烷 | |
| C. | 苯与浓硝酸和浓硫酸的混合液反应生成油状液体;乙烯与水生成乙醇的反应 | |
| D. | 乙烯与溴水反应;乙酸与乙醇的酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 的名称是3,4一二甲基辛烷
的名称是3,4一二甲基辛烷查看答案和解析>>
科目:高中化学 来源: 题型:解答题

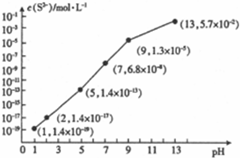
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 1.9 | 6.5 | 4.2 | 5.4 |
| 完全沉淀时的pH | 3.3 | 9.7 | 6.7 | 8.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 | NaF | Na2CO3 | NaClO | NaHCO3 |
| pH | 7.5 | 11.6 | 9.7 | 8.3 |
| A. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF | |
| B. | 等体积等物质的量浓度的NaClO溶液与NaF溶液中离子总数大小:N前<N后 | |
| C. | 若将CO2通入0.1mol/L Na2CO3溶液至溶液中性,则溶液中:2c(CO32-)+c(HCO3-)═0.1mol/L | |
| D. | 向Na2CO3溶液中通入少量的HF气体,化学反应方程式为:Na2CO3+2HF═CO2+H2O+2NaF |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L盐酸15mL | B. | 0.2mol/L盐酸12mL | ||
| C. | 0.15mol/L硫酸8mL | D. | 浓硫酸15mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com