
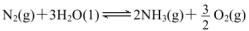
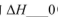 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
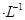 盐酸与0.2 mol
盐酸与0.2 mol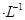 氨水等体积混合,所得混合溶液pH______7(填“>”“<”或“=”,下同),混合溶液中
氨水等体积混合,所得混合溶液pH______7(填“>”“<”或“=”,下同),混合溶液中 (25℃时,NH3.H2O的电离常数
(25℃时,NH3.H2O的电离常数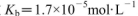 )
)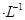 的MgCl2溶液中逐滴加入适量0.lmol
的MgCl2溶液中逐滴加入适量0.lmol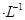 氨水,有白色沉淀生成,向反应后的浊液中,继续加入O.lmol
氨水,有白色沉淀生成,向反应后的浊液中,继续加入O.lmol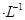 的FeCl3溶液,观察到的现象是______ ;上述过程中发生的所有反应的离子方程式为______。(25℃时,
的FeCl3溶液,观察到的现象是______ ;上述过程中发生的所有反应的离子方程式为______。(25℃时,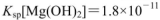 ,
,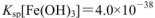 )
)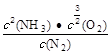 (2分) >(2分)
(2分) >(2分) 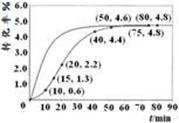
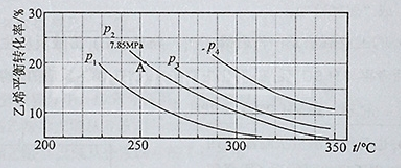
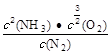 ;根据图像可知,温度升高,生成物NH3的体积分数逐渐增大,说明平衡向右移动,则该反应为吸热反应,?H > 0。
;根据图像可知,温度升高,生成物NH3的体积分数逐渐增大,说明平衡向右移动,则该反应为吸热反应,?H > 0。

科目:高中化学 来源:不详 题型:单选题
 2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是
2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是| A.①④⑥⑦ | B.②③⑤⑦ |
| C.①③④⑤ | D.全部 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH4 (g)+2H2O(g)
CH4 (g)+2H2O(g)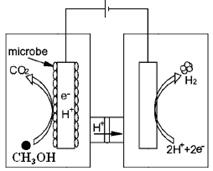
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是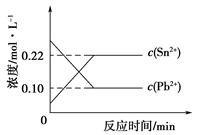
| A.往平衡体系中加入金属铅后,c(Pb2+)增大 |
| B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
| C.升高温度,平衡体系中c(Pb2+)增大,说明该反应⊿H>0 |
| D.25℃时,该反应的平衡常数K=2.2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CH3OH(g) △H<0,下列说法正确的是
CH3OH(g) △H<0,下列说法正确的是| A.一定温度下,压缩容器体积,则正反应速率加快,逆反应速率减慢 |
| B.若v生成(CH3OH)=v消耗(CO),则该反应达到平衡状态 |
C.升高温度,重新达到平衡时,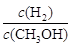 增大 增大 |
| D.使用催化剂,反应的平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
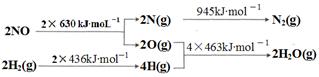
 2NO,是导致汽车尾气中含有NO的原因之一。
2NO,是导致汽车尾气中含有NO的原因之一。 2NO(g)的△H________0(填“>”或“<”)。
2NO(g)的△H________0(填“>”或“<”)。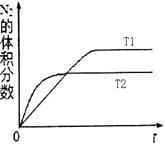
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Ph—CH=CH2(g)+H2(g) △H
Ph—CH=CH2(g)+H2(g) △H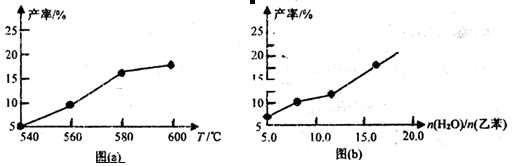

查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
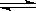 2Z(气),压强一定时,测得在平衡时Z的体积分数为0.4。
2Z(气),压强一定时,测得在平衡时Z的体积分数为0.4。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com