
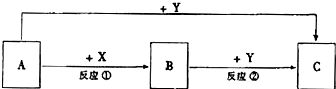
分析 A是常见的金属单质,通常状况下Y单质是气体,A在Y中燃烧生成棕褐色烟,反应①、②均在水溶液中进行,由转化关系可知,A为变价金属,应为Fe,Y为Cl2,B为FeCl2、C为FeCl3,X为HCl.
(1)实验室用二氧化锰与浓盐酸在加热条件下制备氯气,根据电子注意守恒计算氯气物质的量,进而计算氯气体积;
(2)向FeCl2溶液中滴加NaOH溶液并在空气中放置一段时间,先生成氢氧化亚铁沉淀,后被氧化生成氢氧化铁;
(3)为了减缓反应速率而不影响该气体的总量,氢离子浓度减小,氢离子物质的量不变;形成原电池会加快反应速率;
(4)C溶液中阳离子为铁离子,加入适量的KSCN溶液,溶液变血红色.
解答 解:A是常见的金属单质,通常状况下Y单质是气体,A在Y中燃烧生成棕褐色烟,反应①、②均在水溶液中进行,由转化关系可知,A为变价金属,应为Fe,Y为Cl2,B为FeCl2、C为FeCl3,X为HCl,
(1)实验室可用浓盐酸制备氯气,反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;若反应中转移0.05mol电子,则生成氯气的体积在标准状况下为 $\frac{0.05mol}{2}$×22.4L/mol=0.56L,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;0.56L;
(2)向FeCl2溶液中滴加NaOH溶液并在空气中放置一段时间,此过程中的实验现象为:生成白色絮状沉淀,迅速变为灰绿色,最终变为红褐色,其中涉及到的氧化还原反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)Fe与过量的HCl溶液反应生成氯化亚铁与氢气,为了减缓反应速率而不影响该气体的总量,
a.加入Na2CO3(固),碳酸根与氢离子结合为二氧化碳和水,导致溶液中氢离子浓度降低,反应速率降低,影响氢离子总量,故a错误;
b.加入CuSO4(固),会形成原电池,加速反应速率,故b错误;
c.加入K2SO4溶液,相当于加入水稀释,氢离子浓度降低,不影响氢气总量,反应速率减小,故c正确;
d.加入水,氢离子浓度降低,反应速率降低,氢离子总量不变,不影响氢气总量,故d正确;
故答案为:cd;
(4)C溶液中阳离子为铁离子,加入适量的KSCN溶液,Fe3++3SCN-=Fe(SCN)3,溶液变血红色,故答案为:溶液变血红色.
点评 本题考查无机物推断、氧化还原反应计算、化学反应速率影响因素、有关方程式书写等,难度中等,需要学生熟练掌握元素化合物知识.


科目:高中化学 来源: 题型:选择题
| A. | 甲分子中氢的质量分数为40% | |
| B. | 甲和由甲生成的羧酸与醇三者均可溶于水 | |
| C. | 甲在常温常压下为无色液体 | |
| D. | 乙和甲的最简式不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
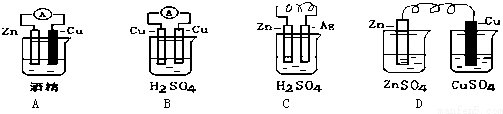
 现有纯铁片、纯银片、纯铜片,稀硫酸、FeSO4 溶液、Fe2(SO4)3溶液、U形管、导线若干,请运用原电池原理设计实验,验证Cu2+、Fe3+的氧化性强弱.
现有纯铁片、纯银片、纯铜片,稀硫酸、FeSO4 溶液、Fe2(SO4)3溶液、U形管、导线若干,请运用原电池原理设计实验,验证Cu2+、Fe3+的氧化性强弱.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、K、Ca | B. | N、P、S | C. | F、Cl、S | D. | O、S、Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| M | N | ||
| X | Y |
 ,(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O,若还原性MN->I-,将适量的(MN)2、I2、KMN、KI在水中混合后,反应的离子方程式为I2+2CN-=2I-+(CN)2.
,(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O,若还原性MN->I-,将适量的(MN)2、I2、KMN、KI在水中混合后,反应的离子方程式为I2+2CN-=2I-+(CN)2.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每生成2mol Na2Mn5O10转移4mol电子 | |
| B. | 正极反应式:Ag+Cl--e-=AgCl | |
| C. | Na+不断向“水”电池的负极移动 | |
| D. | AgCl是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质在融化状态下一定导电 | |
| B. | 常温下反应NH3(g)+HCl(g)=NH4Cl(s)能进行,则△H<0 | |
| C. | 常温下等pH的强酸HA和弱酸HB的两种溶液中,是的电离同等程度被抑制 | |
| D. | 恒温密闭容器中充入一定量的A进行反应:3A(g)?B(g)+2C(g),达到平衡后,在其它条件不变情况下,再充入一定量的A气体,A的转化率将不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com