
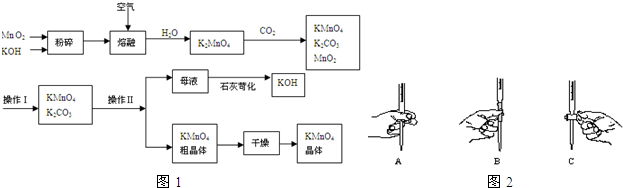
分析 由工艺流程转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,向K2MnO4溶液中通入CO2制备KMnO4、还生成K2CO3、MnO2,通过过滤,分离出二氧化锰,滤液中含KMnO4和K2CO3,根据KMnO4和K2CO3在溶解性上不同采用蒸发结晶的方式可分离出高锰酸钾和碳酸钾,对粗高锰酸钾进行重结晶、干燥得到纯净的高锰酸钾;向碳酸钾溶液中加入石灰生成碳酸钙和氢氧化钠.
(1)由工艺流程转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,根据元素守恒还应生成水.反应中锰元素由+4价升高为+6价,总升高2价,氧元素由0价降低为-2价,总共降低4价,化合价升降最小公倍数为4,所以MnO2系数2,O2系数为1,根据锰元素守恒确定K2MnO4系数,根据钾元素守恒确定KOH系数,根据氢元素守恒确定H2O系数;
(2)高锰酸钾具有强氧化性,常常利用高锰酸钾的强氧化性进行消毒;
(3)制备中利用的原料,在转化过程中又生成的可以循环利用;
(4)分离固体与溶液,采用过滤操作,利用KMnO4和K2CO3在溶解性上进行分离;
(5)KMnO4干燥不能在烘箱中高温烘干,是因为高锰酸钾受热易分解为锰酸钾、二氧化锰、氧气;
(6)①依据酸式滴定管的使用方法分析判断;
②草酸钠标定高锰酸钾溶液的浓度,反应过程中生成的锰离子可能是起到了催化剂作用,反应速率增大;
③反应中MnO4-→Mn2+,Mn元素由+7价→+2价,得5个电子;C2O42-→CO2,C元素由+3价→+4价,一个C2O42-失去2个电子,化合价升高值=化合价降低值=转移电子数,配平方程式,根据反应5C2O42-+2MnO4-+16H+═10CO2↑+2Mn2++8H2O,利用C2O42-和MnO4-的量的关系进行计算.
解答 解:(1)由工艺流程转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,根据元素守恒还应生成水.反应中锰元素由+4价升高为+6价,总升高2价,氧元素由0价降低为-2价,总共降低4价,化合价升降最小公倍数为4,所以MnO2系数2,O2系数为1,根据锰元素守恒确定K2MnO4系数为2,根据钾元素守恒确定KOH系数为4,根据氢元素守恒确定H2O系数为2,所以反应化学方程式为2MnO2+4KOH+O2 $\frac{\underline{\;熔融\;}}{\;}$2K2MnO4+2H2O,
故答案为:2MnO2+4KOH+O2 $\frac{\underline{\;熔融\;}}{\;}$2K2MnO4+2H2O;
(2)a.臭氧具有强氧化性,常常利用臭氧的强氧化性进行杀菌消毒,故a正确;
b.双氧水具有强氧化性,常常利用双氧水的强氧化性进行杀菌消毒,故b正确;
c.苯酚是通过渗透到细菌体内,使细菌蛋白质凝固(变性),从而杀死细菌,故c错误;
d.75%酒精是通过酒精渗透到细菌体内,使细菌蛋白质凝固(变性),从而杀死细菌,故d错误;
故答案为:ab;
(3)制备中利用的原料,在转化过程中又生成的可以循环利用.由转化关系图知,除石灰、二氧化碳外,K2MnO4溶液中通入CO2以制备KMnO4生成的MnO2及最后由母液加入石灰生成的KOH,会在MnO2、KOH的熔融制备K2MnO4中被循环利用,
故答案为:KOH、MnO2;
(4)该操作是分离固体与溶液,是过滤操作,KMnO4和K2CO3在溶解性上不同采用蒸发结晶的方式可分离,
故答案为:过滤;溶解性;
(5)KMnO4粗晶体需要干燥才能得产品,干燥不能在烘箱中高温烘干,原因是:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,受热易分解,
故答案为:KMnO4受热易分解;
(6)①使用酸式滴定管时,应将滴定管固定在滴定管夹上,活塞柄向右,左手从中间向右伸出,拇指在管前,食指及中指在管后,三指平行地轻轻拿住活塞柄,无名指及小指向手心弯曲,食指及中指由下向上顶住活塞柄一端,拇指在上面配合动作.在转动时,中指及食指不要伸直,应该微微弯曲,轻轻向左扣住,这样既容易操作,又可防止把活塞顶出,
故答案为:A;
②草酸钠标定高锰酸钾溶液的浓度,反应过程中生成的锰离子可能是起到了催化剂作用,反应速率增大,
故答案为:Mn2+具有催化作用;
③反应中MnO4-→Mn2+,Mn元素由+7价→+2价,一得5个电子;C2O42-→CO2,C元素由+3价→+4价,一个C2O42-失去2个电子,化合价升高值=化合价降低值=转移电子数=10,由电子守恒和原子守恒可知,反应为5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O,根据反应5C2O42-+2MnO4-+16H+═10CO2↑+2Mn2++8H2O,则5C2O42-~2MnO4-,m的平均数值为1.340g,即Na2C2O4的物质的量n=$\frac{m}{M}$=$\frac{1.34g}{134g/mol}$=0.0100mol,即C2O42-的物质的量为0.0100mol,所以KMnO4溶液的物质的量为0.0040mol,据C=$\frac{n}{V}$=$\frac{0.004mol}{0.025L}$=0.1600mol/L,
故答案为:0.1600.
点评 本题以制备高锰酸钾为载体考查了常见氧化剂与还原剂、氧化还原反应、化学计算和对工艺流程的理解、阅读题目获取信息的能力等,解答本题时要充分理解图中提供的信息,只有理解了图中信息才能对问题做出正确的判断,题目难度中等.


科目:高中化学 来源: 题型:填空题
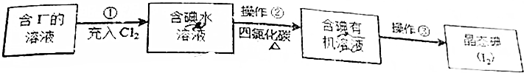
 铜是过渡元素.化合物中,铜常呈现+1价或+2价.
铜是过渡元素.化合物中,铜常呈现+1价或+2价. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.44S | B. | 1S | C. | 1.33S | D. | 2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的CH4、C2H4、C2H2分别在氧气中完全燃烧,消耗氧气的量依次减少 | |
| B. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| C. | 苯的结构比较稳定,发生取代反应相对比较容易,发生苯环结构被破坏的加成反应困难得多,而氧化反应不能发生 | |
| D. | 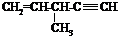 催化加氢可生成3-甲基己烷 催化加氢可生成3-甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向淀粉溶液中加入稀硫酸,加热一段时间后再加入银氨溶液,水浴加热,检验淀粉是否水解 | |
| B. | 向甲酸和甲醛的混合物中加入氢氧化钠溶液,中和甲酸后,加入新制的氢氧化铜加热,检验混合物中是否含有甲醛 | |
| C. | 制硝基苯时,将盛有混合液的试管加热,控制温度100-110℃ | |
| D. | 要鉴别己烯中是否混有甲苯,应先加足量溴水,然后再加入酸性高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸钠溶液 | B. | AgN03溶液 | C. | 碳酸钠溶液 | D. | 紫色石蕊试液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含碳氢键数目为$\frac{a{N}_{A}}{7}$ | |
| B. | 常温常压,完全燃烧时消耗的O2一定是$\frac{33.6a}{14}$L | |
| C. | 所含共用电子对数目为($\frac{a}{7+1}$)NA | |
| D. | 所含原子总数为$\frac{a{N}_{A}}{14}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
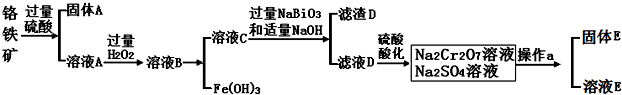
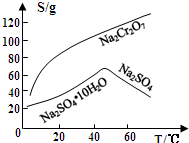

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com