
˫��Ĥ����������NaCl��Һ�Ʊ�����ԭ����Ϊ��ߺ�ˮ�����ĸ���ֵ�ṩ���µļ���·������֪BPΪ˫��Ĥ������Ĥ������Խ���H+��OH��������˵����ȷ���ǣ� ��
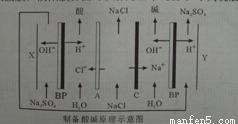
A��AΪ�����ӽ���Ĥ��CΪ�����ӽ���Ĥ
B��XΪ�����������ĵ缫��Ӧ����ʽΪ��4OH����4e��=O2��+2H2O
C����X��Y���Ҽ���Na2SO4��Ŀ�����ṩ�Ʊ�����ͼ�������ӻ�������
D��ͨ����װ�ã�������ˮ�õ��˵�����ͬʱ�����Եõ�NaOH��HCl��H2��O2������

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ������ʡ�����ж�������ѧУ�߶������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
ij��̬������ϩ���Ļ����9g�����ܶ�Ϊ��ͬ״���������ܶȵ�11.2�������������ͨ����������ˮ����ˮ����4.2g����ԭ�����������Ϊ�� ��
A����������ϩ B����������ϩ C���������ϩ D�������붡ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꺣�ϻ�����ѧ����ѧУ�߶�����ĩ���ƻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�Ҵ���CH3CH2OH���Ͷ����ѣ�CH3��O��CH3����Ϊ��ͬ���칹�������Ϊ�� ��
A��̼���칹 B��λ���칹 C���������칹 D��˳���칹
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ȫ������ģ���Ծ��ܽữѧ�Ծ� ���ͣ�ѡ����
��2016•������У��ģ�⣩�������ӷ���ʽ��H++OH���TH2O����ʾ�Ļ�ѧ��Ӧ�ǣ�������
A��CaCO3+2HCl�TCaCl2+CO2��+H2
B��2KOH+MgCl2�T2KCl+Mg��OH��2��
C��Ba��OH��2+H2SO4�TBaSO4��+2H2O
D��NaOH+HCl�TNaCl+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���㽭ʡ�����������и߿���ģ��ѧ�Ծ��������棩 ���ͣ������
Һ���Ͷ���̼��һ�������·�Ӧ�������ɼ��������Σ�2.55g�����Ȼ���ȫ�ֽ����ɵ����ʵ�����������Ͷ���2.24L�������������ʹ��ɫʯ����Һ��������ȡ����FeCl3��Һ�������еμӼ���Һ��������Һ��ΪѪ��ɫ�����ƲⲢ�ش�
��1�������ӷ���ʽ��ʾ��ɫʯ����Һ����ԭ�� ��
��2��д�������ȷֽ�Ļ�ѧ����ʽ ��
��3������Һ�м�������ŨNaOH��Һ�����Ⱥ�Ҳ�������������д���÷�Ӧ�����ӷ���ʽ ��
��4��������Ļ�ѧʽΪ ��
��5��������Ѫ��ɫ��Һ��ͨ��SO2��������Һ��ɫ��ȥ�����������ԭ��Ӧ�ĽǶȽ��ͺ�ɫ��ȥ��ԭ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�츣��ʡ��ƽ���ֳ��ظ߿�ģ�⻯ѧ�Ծ��������棩 ���ͣ������
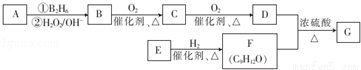
ijһԪ����֬G����ʳ�����ϣ����ĺϳ�·��֮һ��ͼ��ʾ��A��ϩ��������Է�������Ϊ56��D���ӵĺ˴Ź�����������������ҷ����֮��Ϊ6��1��1��E����������Һ��Ӧ��F����������1molE��1molF�ֱ���ȫȼ��ʱ��F���ɵ�ˮ��E�Ķ�2 mol��
��֪��R��CH�TCH2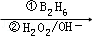 RCH2CH2OH
RCH2CH2OH
�ش��������⣺
��1����ϵͳ����������B������Ϊ E�й����ŵ������� ��
��2��A�Ľṹ��ʽ�� ������ʵ����ֻ��һ���Լ�����Ҫ�ķ�Ӧ��������B��C��D������Լ��� ��
��3��D��F��Ӧ�Ļ�ѧ����ʽΪ ���÷�Ӧ�ķ�Ӧ����Ϊ ��
��4����������������F��ͬ���칹���� �֣�
������NaOH��Һ��Ӧ �ڷ�������2��һCH3
���к˴Ź���������5���Ľṹ��ʽΪ ��
��5���� Ϊԭ��Ҳ�ɺϳ�F����ο���Ŀ�е������Ϣд����Ӧ�ĺϳ�·��ͼ����Ӧ�����е��Լ�д�ڼ�ͷ�Ϸ�������д�ڼ�ͷ�·����� ��
Ϊԭ��Ҳ�ɺϳ�F����ο���Ŀ�е������Ϣд����Ӧ�ĺϳ�·��ͼ����Ӧ�����е��Լ�д�ڼ�ͷ�Ϸ�������д�ڼ�ͷ�·����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�츣��ʡ��ƽ���ֳ��ظ߿�ģ�⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
ѡ�� | ʵ����� | ʵ��Ŀ�� |
A | ��������������ͨ����ɫʯ����Һ�У��۲���Һ��ɫ�仯 | ֤��������̼����Ư���� |
B | ��2mL1mol•L��1NaOH��Һ���ȼ���3��1mol•L��1FeCl3��Һ���ټ���3��1mol•L��1MgCl2��Һ | ֤��Ksp[Mg��OH��2]��ksp[Fe��OH��3] |
C | ��2mLƷ����Һ��2mL�������������Ʒ����Һ�зֱ����3�κ�NaClO�ġ�84������Һ���۲��ɫ��ɫ�Ŀ��� | ֤��������ҺpH�ļ�С����84������Һ������������ǿ |
D | ��ͬ�¶��£�����֧ʢ����ͬ�����ͬŨ��H2O2��Һ���Թ��зֱ����������ͬŨ�ȵ�CuSO4��Һ��FeCl3��Һ | ̽��Cu2+��Fe3+��H2O2�ֽ����ʵ�Ӱ�� |
A��A B��B C��C D��D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ������ʡ��«������УЭ���������߶������л�ѧ�Ծ��������棩 ���ͣ������
A��B��C��D��EΪǰ36��Ԫ�أ����ǵĺ˵�������ε�������֪��A��ԭ�Ӱ뾶��С��Ԫ�أ�Bԭ�Ӻ���������δ�ɶԵ��ӣ���B���γɻ�������������Ԫ�أ�B��C��D����ͬ���ڣ�C�ĵ�һ�����ܴ���ǰ������Ԫ�أ�D�ĵ縺�Խϴ����ڷ�Ԫ�أ�E��ǰ��������δ�ɶԵ���������Ԫ�أ�
��ش��������⣺
��1��EԪ��ԭ�ӵ���Χ�����Ų�ʽΪ ��C�ĵ�һ�����ܴ������������Ԫ�ص�ԭ���� ��
��2��ʵ����A2D�������ܶȱ���ͬ����������ֵ����ƫ�������ܵ�ԭ���� ��
��3��A��B��C�γɵ���ԭ�ӷ�����B���ӻ��������Ϊ ���÷����к��еĦҼ��ͦм�����Ŀ֮��Ϊ ��
��4��+3�۵�E�γɵİ����������ECla•bNH3����1mol�����������AgNO3��Һ��������2molAgCl��������b= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ��ͨ������и�һ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
�ں��д���Ba2+��OH����Cl������Һ�У������ܴ�������������ǣ� ��
A��HCO3�� B��NO3�� C��NH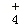 D��Al3+
D��Al3+
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com