
【题目】将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加入3 mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g。下列叙述不正确的是( )
A. 当生成的沉淀量达到最大时,消耗NaOH 溶液的体积V≥100 mL
B. 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4 mol
C. 参加反应的金属的总质量9.6 g>m>3.6 g
D. 当金属全部溶解时收集到 NO气体的体积一定为2.24 L
【答案】D
【解析】试题分析:将一定量的镁和铜组成的混合物加入到稀HNO3中,金属完全溶解(假设反应中还原产物只有NO),发生反应:3Mg+8HNO3 (稀)=3Mg(NO3)2+2NO↑+4H2O;3Cu+8HNO3 (稀)=3Cu(NO3)2+2NO↑+4H2O;向反应后的溶液中加入过量的3mol/L NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3;Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g,氢氧根的物质的量为![]() =0.3mol,根据电子转移守恒,则镁和铜的总的物质的量为0.15mol;A.若硝酸无剩余,则参加反应氢氧化钠的物质的量等于0.3mol,需要氢氧化钠溶液体积=
=0.3mol,根据电子转移守恒,则镁和铜的总的物质的量为0.15mol;A.若硝酸无剩余,则参加反应氢氧化钠的物质的量等于0.3mol,需要氢氧化钠溶液体积=![]() =0.1L=100mL,硝酸若有剩余,消耗的氢氧化钠溶液体积大于100mL,故A正确;B.根据方程式可知参加反应的n反应(HNO3)=n(金属)=0.15mol×=0.4mol,故B正确;C.镁和铜的总的物质的量为0.15mol,假定全为镁,质量为0.15mol×24g/mol=3.6g,若全为铜,质量为0.15mol×64g/mol=9.6g,所以参加反应的金属的总质量(m)为3.6g<m<9.6g,故C正确;D.镁和铜的总的物质的量为0.15mol,根据电子转移守恒可知生成的NO物质的量为
=0.1L=100mL,硝酸若有剩余,消耗的氢氧化钠溶液体积大于100mL,故A正确;B.根据方程式可知参加反应的n反应(HNO3)=n(金属)=0.15mol×=0.4mol,故B正确;C.镁和铜的总的物质的量为0.15mol,假定全为镁,质量为0.15mol×24g/mol=3.6g,若全为铜,质量为0.15mol×64g/mol=9.6g,所以参加反应的金属的总质量(m)为3.6g<m<9.6g,故C正确;D.镁和铜的总的物质的量为0.15mol,根据电子转移守恒可知生成的NO物质的量为![]() =0.1mol,若为标准状况下,生成NO的体积为0.1mol×22.4L/mol=2.24L,但NO不一定处于标准状况,收集到NO气体的体积不一定为2.24L,故D错误;故选D。
=0.1mol,若为标准状况下,生成NO的体积为0.1mol×22.4L/mol=2.24L,但NO不一定处于标准状况,收集到NO气体的体积不一定为2.24L,故D错误;故选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O.一定质量的二氧化锰溶解在100mL过量的浓盐酸中,当反应生成 4.48L 氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(假设反应前后体积不变).请计算:
MnCl2+Cl2↑+2H2O.一定质量的二氧化锰溶解在100mL过量的浓盐酸中,当反应生成 4.48L 氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(假设反应前后体积不变).请计算:
(1)反应耗用MnO2的质量
(2)被氧化的HCl物质的量
(3)原浓盐酸的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.锌是人体健康所必需的元素,葡萄糖酸锌是一种常用的补锌剂,对婴儿及青少年的智力和身体发育有重要作用。工业上以葡萄糖酸钙为原料通过如下两步制备葡萄糖酸锌:
![]()
步骤1:充分反应后,过滤除去CaSO4沉淀。
步骤2:将葡萄糖酸溶液与ZnO混合。
(1)步骤2中,待其充分反应后,须继续加入葡萄糖酸溶液至pH为5.8,目的是_________。
(2)下列物质可替代ZnO的是______(填字母)。
a.NH3·H2O b.Zn(OH)2 c.NaOH d.ZnSO4 e.ZnCO3
Ⅱ.葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→ (C6H11O7)2 Ca (葡萄糖酸钙)+H2O+CO2
相关物质的溶解性见下表:
物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
实验流程如下:

请回答下列问题:
(3)第①步中溴水氧化葡萄糖可以用下图装置,其中水浴加热的原因是_____________。

(4)第②步中所加CaCO3还发生了其他反应,写出其中一个主要反应的方程式________;
(5)第③步需趁热过滤,原因是______________________;第④步加入乙醇的作用是______________________;
(6)第⑥步中,下列洗涤剂最合适的是________。
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对反应[可用aA(g)+bB(g)![]() cC(g)表示]化学平衡的影响,得到如下图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率,φ表示体积分数):
cC(g)表示]化学平衡的影响,得到如下图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率,φ表示体积分数):

分析图像,回答下列问题:
(1)在图象反应Ⅰ中,若p1>p2,则此正反应为______(填“吸热”或“放热”)反应,也是一个气体分子数________(填“减小”或“增大”)的反应,由此判断,此反应自发进行必须满足的条件是________。
(2)在图象反应Ⅱ中,T1________T2(填“>”“<”或“=”),该正反应为_______(填“吸热”或“放热”)反应。
(3)在图象反应Ⅲ中,若T2>T1,则此正反应为_________________________(填“吸热”或“放热”)反应。
(4)在图象反应Ⅳ中,若T1>T2,则该反应能否自发进行?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图与对应的反应情况符合的是( )
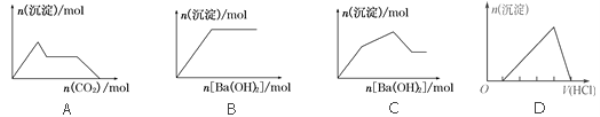
A. 向含0.01 mol KOH和0.01 mol Ca(OH)2的混合溶液中缓慢通入CO2至过量
B. 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量
C. 向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至过量
D. 向含有少量氢氧化钠的NaAlO2溶液中逐滴加入盐酸至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 摩尔是物质的数量的单位 B. 氢气的摩尔质量是2g
C. 1 mol OH—的质量是17g D. 气体摩尔体积为22.4mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。

(1)三种乙醇燃料电池中正极反应物均为_____________。
(2)碱性乙醇燃料电池中,电极a上发生的电极反应式为______________________________,使用空气代替氧气,电池工作过程中碱性会不断下降,其原因是_____________________________。
(3)酸性乙醇燃料电池中,电极b上发生的电极反应式为__________________________________。
(4)熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,CO32-向电极______(填“a”
或“b”)移动,电极b上发生的电极反应式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度和压强下,对反应CO2(g)+ H2(g)![]() CO(g)+ H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
CO(g)+ H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:

上述四种情况达到平衡后,n(CO)的大小顺序是
A.乙=丁>丙=甲 B.乙>丁>甲>丙
C.丁>乙>丙=甲 D.丁>丙>乙>甲
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com