
 (2)共价
(2)共价 H2O + NH3↑
H2O + NH3↑  。
。 H2O + NH3↑。既能与盐酸反应又能与氯水反应的是亚硫酸铵,亚硫酸铵与氯水反应离子方程式为SO32- + Cl2 + H2O = SO42- + 2Cl- + 2H+ 。
H2O + NH3↑。既能与盐酸反应又能与氯水反应的是亚硫酸铵,亚硫酸铵与氯水反应离子方程式为SO32- + Cl2 + H2O = SO42- + 2Cl- + 2H+ 。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.分散系的分类: |
B.氯化铝溶液中滴加氢氧化钠溶液后铝元素的存在形式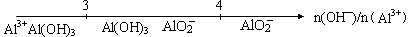 |
C.铁和稀硝酸反应后溶液中铁元素的存在形式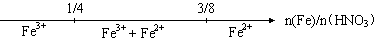 |
| D.二氧化碳通入澄清的石灰水中反应的产物 |
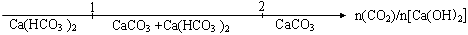
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 的NaOH溶液,出现了如图中a、b、c三个阶段的图像,
的NaOH溶液,出现了如图中a、b、c三个阶段的图像,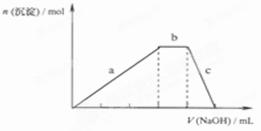
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SO2具有漂白性,故可使酸性KMnO4溶液褪色 |
| B.浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色 |
| C.Na的金属性比Mg强,故可用Na与MgCl2溶液反应制取Mg |
| D.Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中Fe也显+3价 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氢氧化钠用于治疗胃溃疡病人的胃酸过多症 | B.在AlCl3溶液中加入过量氨水最终无沉淀生成 |
| C.工业上可利用钠和TiCl4溶液反应制取金属Ti | D.锅炉中水垢可用盐酸或醋酸除去 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.除去N2中的少量O2:通过灼热的Cu粉,收集气体 |
| B.铅蓄电池在放电时,Pb作为负极,不断转化为PbSO4 |
| C.用盐酸酸化KMnO4溶液可以增强其氧化性 |
| D.强电解质在水中溶解度不一定大于弱电解质在水中的溶解度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com