
已知有以下物质相互转化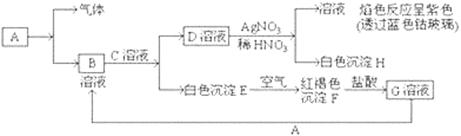
试回答:(1)写出E的化学式 ,H的化学式 。
(2)写出由E转变成F的化学方程式 。
(3)检验G溶液中的金属阳离子的方法是: ;
向G溶液加入A的有关离子反应方程式 。
(4)写出A在一定条件下与水反应的化学方程式 。
(1)Fe(OH)2 AgCl(2)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)取少量G溶液于试管中,向试管中滴加少量KSCN溶液,若出现红色,则证明溶液中有Fe3+;2Fe3++Fe=3Fe2+
(4)3Fe+4H2O(g) Fe3O4+4H2
Fe3O4+4H2
解析试题分析:(1)焰色反应显紫色,说明D溶液中含有K元素。又因为D能和硝酸银溶液反应生成白色沉淀氯化银,所以D应该是氯化钾。EF的转化以及沉淀颜色可知,E是氢氧化亚铁、F是氢氧化铁,G则氯化铁。B和C反应生成氯化钾和氢氧化亚铁,所以BC是氢氧化钾和氯化亚铁。G能和A反应生成B,所以A是铁,B是氯化亚铁,C是氢氧化钾,气体是氢气。
(2)由E转变成F,即Fe(OH)2转化为Fe(OH)3,化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)检验G溶液中的金属阳离子,即检验Fe3+,可用KSCN溶液检验;向G溶液加入A,Fe3+被Fe还原为Fe2+,离子方程式为:2Fe3++Fe=3Fe2+。
(4)Fe在高温条件下与水蒸气反应生成Fe3O4和H2,化学方程式为3Fe+4H2O(g) Fe3O4+4H2
Fe3O4+4H2
考点:本题考查无机框图的分析与推断、方程式的书写、离子的检验。


科目:高中化学 来源: 题型:填空题
以黄铜矿(主要成分为CuFeS2,含少量杂质SiO2等)为原料进行炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下: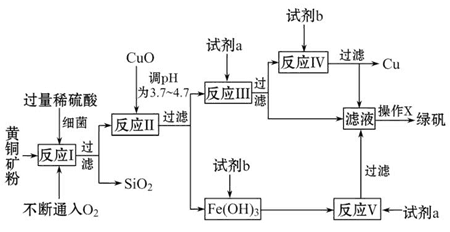
已知:① 4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 6.7 | 3.7 | 9.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有Fe、Cu组成的合金,其中Cu、Fe的总物质的量为a mol,Cu的物质的量分数为x;研成粉末后,全部投入含b mol HNO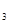 的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:
的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:
(1)若剩余的残渣只有Cu,则溶液中含有的金属离子为__________。(写出所有可能情况)
(2)当溶液中金属离子只有Fe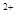 、Cu
、Cu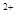 时,则b的取值范围是(用a、x表示)___________。
时,则b的取值范围是(用a、x表示)___________。
(3)当x=0.5,溶液中Fe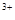 与Fe
与Fe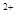 的物质的量相等时,在标准状况下共产生672 mL气体。则a=____________、b=_____________。
的物质的量相等时,在标准状况下共产生672 mL气体。则a=____________、b=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下: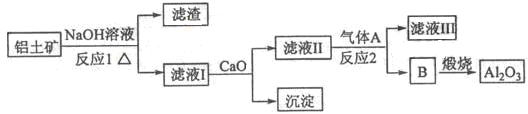
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下: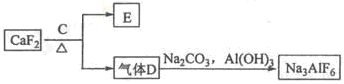
回答下列问题:
(1)写出反应1的化学方程式 ;
(2)滤液Ⅰ中加入CaO生成的沉淀是 ,反应2的离子方程式为 ;
(3)E可作为建筑材料,化合物C是 ,写出由D制备冰晶石的化学方程式 ;
(4)电解制铝的化学方程式是 ,以石墨为电极,阳极产生的混合气体的成分是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁元素及其化合物与人类的生产生活息息相关,试回答下列问题:
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该反应的离子方程式为 。
(2)已知:Fe(s)+ O2(g)
O2(g)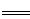 FeO(s) △H=-272 kJ·mol-1
FeO(s) △H=-272 kJ·mol-1
C(s)+O2(g) CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-1
2C(s)+O2(g) 2CO(g) △H=-221 kJ·mol-1
2CO(g) △H=-221 kJ·mol-1
则高炉炼铁过程中 FeO(s)+CO(g) Fe(s)+CO2(g) △H= 。
Fe(s)+CO2(g) △H= 。
(3)铁红(Fe2O3)是一种红色颜料。将一定量的铁红溶于160mL 5 mol·L-1盐酸中,再加入足量铁粉,待反应结束共收集到气体2.24L(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为 。
(4)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如下图所示,其中P端通入CO2。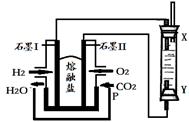
①石墨I电极上的电极反应式为 。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是 (填序号)。
| A.X、Y两端都必须用铁作电极 |
| B.可以用NaOH溶液作为电解液 |
| C.阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH- |
| D.白色沉淀只能在阳极上产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
据此回答下列问题:
(1)图中涉及分离溶液与沉淀的方法是__________________。
(2)B、C、D 三种物质的化学式为:B_________ C_________ D_________
(3)沉淀E与稀硫酸反应的离子方程式为________________________________________。
(4)将沉淀F中存在的两种金属元素组成的合金溶于100 mL 4mol/LHCl溶液中,然后再滴加1 mol/L NaOH溶液,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。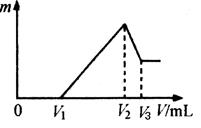
已知V1=160mL。根据以上信息回答:
①_________(填“能”或“不能”)计算出V3
②V2为_________mL(若能算出具体数字,请在横线上填写具体数字;若不能请在横线上填“不能确定”)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
据新华社报道,发展改革委员会于2007年4月发出“遏制铝冶炼投资反弹”的紧急通知。原因是铝冶炼属高耗能产业,而且某些铝冶炼企业以污染环境为代价,得不偿失。
如图是传统的工业生产金属铝的基本流程图,阅读上述新闻信息,结合铝生产的流程图解答下列问题: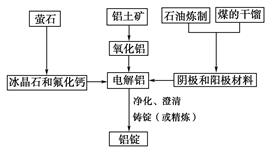
请回答:
(1)工业冶炼金属铝用的是铝土矿,铝土矿的主要成分是________(填化学式)。石油炼制和煤的干馏产品____________(填物质名称)作电解铝的阴极和阳极材料。
(2)氧化铝熔点高达2050 ℃,工业上为了降低能量消耗,在金属铝的冶炼中采取的措施是__________________________。
(3)在冶炼过程中,阳极材料需要定期地进行更换,原因是该极材料不断被消耗,产生这种现象的原因是:__________________________________________(用化学方程式表示)。
(4)工业上制取金属镁时是电解MgCl2,电解反应方程式为_________________,镁和铝都是活泼金属,为什么在电解冶炼过程中,一个用氯化物,一个用氧化物?原因是:
________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知A、B、C、D为常见单质,其中B、C、D常温常压下为气体,甲、乙、丙、丁为化合物,乙常温下为液体,丙的焰色反应为黄色,下图为各种物质之间的相互反应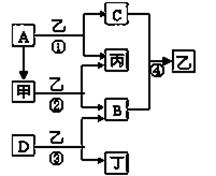
(1)写出下列物质的化学式:
A ,B ,D ,丙 。
(2)丙电子式为 ,反应②中若有11.2L(标准状况下)B生成,则发生转移的电
子的物质的量为 。
(3)写出反应③的化学方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。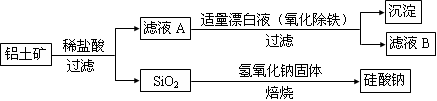
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①检验滤液B中是否还含有铁元素的方法为: (注明试剂、现象)。
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为 (填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、 (填操作名称)、洗涤。
④该过程中涉及某氧化还原反应如下,请完成:
□Fe2++ □ClO-+ □ = □Fe(OH)3↓+ □C1-+ □ 。
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。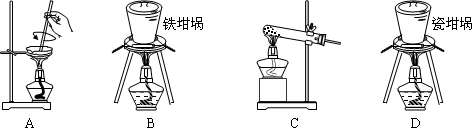
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com