
【题目】与0.2 L 1 mol/L FeCl3溶液中的氯离子的数目相同是( )
A.0.2 L 1 mol/L KCl溶液B.0.6 mol HCl气体
C.0.2 L 3 mol/L KClO3溶液D.0.6mol NaCl晶体
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】CH3CH2CH2CH3(g)+![]() O2(g)=4CO2(g)+5H2O(l) ΔH=-2878kJ/mol,(CH3)2CHCH3(g)+
O2(g)=4CO2(g)+5H2O(l) ΔH=-2878kJ/mol,(CH3)2CHCH3(g)+![]() O2(g)=4CO2(g)+5H2O(l)ΔH=-2869kJ/mol,下列说法正确的是
O2(g)=4CO2(g)+5H2O(l)ΔH=-2869kJ/mol,下列说法正确的是
A.正丁烷与异丁烷的能量大小关系如图
B.正丁烷的稳定性大于异丁烷
C.异丁烷转化为正丁烷的过程是一个放热过程
D.异丁烷分子中的碳氢键比正丁烷的多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Fe2(SO4)3和CuSO4的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示。则该溶液中Fe2(SO4)3与CuSO4的物质的量浓度之比为
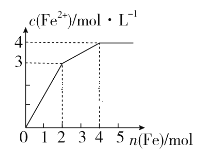
A.3∶1B.1∶2C.2∶1D.1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.00mol·L-1盐酸滴入20.00mL1.00mol·L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示。
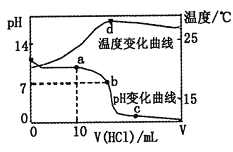
下列有关说法中不正确的是( )
A. a点溶液中离子浓度大小关系:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
B. b点溶液中离子浓度大小关系:c(NH4+)=c(Cl-)>c(H+)=c(OH-)
C. c点溶液中离子浓度大小关系:c(NH4+)+c(H+)=c(Cl-)+c(OH-)
D. d点时溶液温度达到最高,之后温度略有下降,原因是NH3·H2O电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某饱和链烃的含氧衍生物X具有如下性质:X+H2O![]() Y+Z,其中Y的摩尔质量为46g/mol。若X分子中有6个碳原子,则X的结构(不考虑立体结构)最多有( )
Y+Z,其中Y的摩尔质量为46g/mol。若X分子中有6个碳原子,则X的结构(不考虑立体结构)最多有( )
A.10种B.8种C.7种D.6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知亚磷酸(H3PO3)的结构如图![]() ,具有强还原性的二元弱酸,可以被银离子氧化为磷酸。
,具有强还原性的二元弱酸,可以被银离子氧化为磷酸。
(1)已知亚磷酸可由PCl3水解而成,请写出相应的方程式___;
(2)Na2HPO3是________(填“正盐”或“酸式盐”);
(3)亚磷酸与银离子反应时氧化剂与还原剂的物质的量之比为______________;
(4)某温度下,0.10molL-1的H3PO3溶液的pH为1.6,即c(H+)=2.5×10-2molL-1,该温度下H3PO3的一级电离平衡常数Ka1=______;(H3PO3第二步电离忽略不计,结果保留两位有效数字)
(5)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:c(Na+)_____c(H2PO3-)+2c(HPO32-)(填“>”、“<”或“=”);
(6)向某浓度的亚磷酸中滴加NaOH溶液,其pH与溶液中的H3PO3、H2PO3—、HPO32—的物质的量分数a(X)(平衡时某物种的浓度与整个物种浓度之和的比值)的关系如图所示。
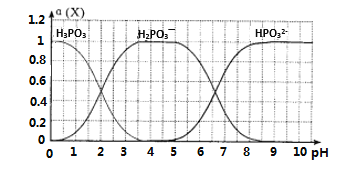
以酚酞为指示剂,当溶液由无色变为浅红色时,发生主要反应的离子方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。硫化钠广泛应用于冶金染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C![]() Na2S+2CO2↑。下列说法正确的是
Na2S+2CO2↑。下列说法正确的是
A.4.2g14C原子含中子数目为1.8NA
B.1L0.1mol/LNa2S溶液中含阴离子的数目小于0.1NA
C.该反应中,若生成1mol氧化产物,转移电子数目为4NA
D.常温下2.24LCO2中共用电子对数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为3.8 ℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水反应生成HClO。
(制备产品)将氯气和空气(不参与反应)按体积比1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O(不含Cl2)制备次氯酸溶液。
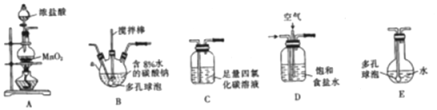
(1)各装置的连接顺序为______→ → →C→ 。
(2)装置B中多孔球泡和搅拌棒的作用是____________________________________ ;装置C的作用是_____________________。
(3)制备Cl2O的化学方程式为________________________。
(4)反应过程中,装置B需放在冷水中,其目的是_____________________________。
(5)此方法相对于用氯气直接溶于水制备次氯酸溶液有两个主要优点,分别是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铁的化合物的说法不正确的是
A.实验室为了暂时妥善保存硫酸亚铁溶液,常加入少量的铁粉
B.某溶液若加入KSCN溶液,无变化,但通入Cl2后变血红色,说明原溶液中含有Fe2+
C.欲检验FeSO4溶液是否全部变质,可加入少量酸性高锰酸钾溶液观察紫色是否褪去
D.将适量铁粉放入FeCl3溶液中完全反应后,溶液中Fe2+和Fe3+的浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比为1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com