
| A. | 氨气能使湿润的蓝色石蕊试纸变为红色 | |
| B. | N2中有少量的杂质CO,可将混合气体通过灼热的氧化铜除去CO | |
| C. | 200mL3mol.L-1BaCl2溶液跟100mL3mol.L-1KCl溶液混合后,溶液中c(Cl-)仍然是3 mol/L | |
| D. | 溶液、浊液、胶体的本质区别是粒子直径的大小不同 |
分析 A.湿润的红色色石蕊试纸遇到碱变蓝;
B.氮气性质稳定,一氧化碳少量,在氮气氛围中一氧化碳难与氧化铜反应;
C.两溶液中氯离子的浓度不相同;
D.根据三类分散系的本质差异是分散质粒子的大小解答.
解答 解:A.氨气是碱性气体,能使湿润的红色色石蕊试纸变蓝,故A正确;
B.氮气性质稳定,一氧化碳少量,在氮气氛围中一氧化碳难与氧化铜反应,故B错误;
C.3mol•L-1的BaCl2溶液中氯离子浓度为6mol•L-1,3mol•L-1的KCl溶液中氯离子浓度为L3mol•L-1,混合后氯离子浓度,介于之间3mol•L-1~6mol•L-1,故C错误;
D.根据分散质粒子直径大小来分类,把分散系划分为:溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm).所以,溶液、胶体和浊液这三种分散系的本质的区别在于分散质粒子直径大小,故D正确;
故选:D.
点评 本题考查了元素化合物知识,熟悉氨气、氮气的性质,熟悉分散系分类依据是解题关键,题目难度不大.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫代硫酸钠(Na2S2O3•5H2O)是一种脱氯剂,它易溶于水,难溶于乙醇,40~45℃熔化,48℃分解,由硫化钠和亚硫酸钠制备,涉及的反应原理为:
硫代硫酸钠(Na2S2O3•5H2O)是一种脱氯剂,它易溶于水,难溶于乙醇,40~45℃熔化,48℃分解,由硫化钠和亚硫酸钠制备,涉及的反应原理为: .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2A+3B=2C | B. | A+3B=2C | C. | 3A+B=2C | D. | A+B=C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | Na2O2 溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | 大理石溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
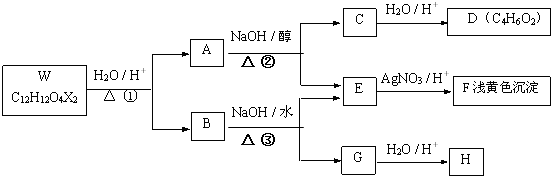

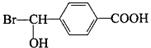
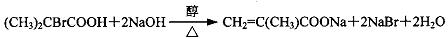
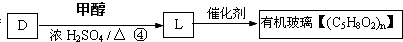 ,反应④的化学方程式是
,反应④的化学方程式是
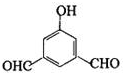 、
、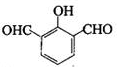 、
、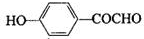 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3,3-二甲基-1-丁烯在一定条件下与氢气充分反应后得到3,3-二甲基丁烷 | |
| B. | 工业生产中用乙醇与氢氧化钠作用生成乙醇钠,故乙醇可以与氢氧化钠溶液反应 | |
| C. | 地球上最基本的能源是太阳能,植物通过光合作用吸收太阳能,被吸收的太阳能通过各种形式的化学反应转化为化学能,物质中的化学能又可以通过各种形式的化学反应转化为热能、光能或电能 | |
| D. | 道尔顿、汤姆生、卢瑟福、波尔和门捷列夫等科学家对原子结构模型的建立均作出了卓越的贡献 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com