
| ��ʼŨ�� | c��H2��/mol/L | c��I2��/mol/L | c��HI��/mol/L |
| �� | 0.01 | 0.01 | 0 |
| �� | 0.02 | 0.02 | 0 |
| A��ƽ��ʱ������H2��ת�����Ǽ��е�2�� |
| B��ƽ��ʱ�����л�������ɫ�������� |
| C��ƽ��ʱ���ס����������ı仯ֵ��� |
| D�����¶��£���Ӧ��ƽ�ⳣ��K=0.25 |
| 0.0042 |
| 0.008��0.008 |


 Ӧ������ҵ��ϵ�д�
Ӧ������ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| 1 |
| 2 |
| c(N2)c2(CO2) |
| c2(NO)c2(CO) |
| c(N2)c2(CO2) |
| c2(NO)c2(CO) |
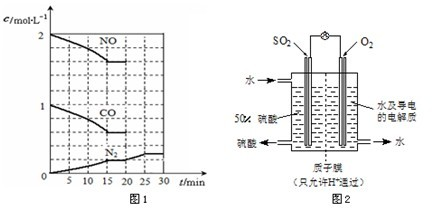
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ�꽭��ʡ̩���и�����һ��ģ�⿼�Ի�ѧ�� ���ͣ�ʵ����
��14�֣������ͣ�������Ὣ�����⾭��ʱ����Ŀǰ���ģ���ⷽʽ���ǻ�ѧ���⡣
I������������
�Լ״�Ϊ������Ӧ��������һ��;���У�
CH3OH��l��=2H2��g����CO��g�� ��H1=��128 kJ��mol��1
CH3OH��l����H2O��l��=3H2��g����CO2��g�� ��H2= a kJ��mol��1
��֪��H2��g����1/2O2��g��=H2O��l�� ��H=��286 kJ��mol��1
Ϊ��á�H2����Ҫ֪�� ��ȼ���ȣ�����ȼ����Ϊ��H=һ283 kJ��mol��1�����H2= ��
�����û�����
��1���о����������и�Ľ���������кܸߵķ�Ӧ���ԡ����������Ͻ���ˮ�б��и�������ʱ���Գ������ͷų�������ʹ������ˮ��Ӧ��������ʹ���������ý�����ˮ��Ӧ���������ŵ��У��ټ������ɱ��ϵͣ��� ��
��2��������Ȼ�������õ���CO��H2������Խ�����������л�ԭ��Ȼ������ˮ��Ӧ�ų��������ɴ˴��һ������ѭ�������ݸ�����ѧ��֪ʶ����Ԥ��ý������ʣ���д���ý����ڼ��ȵ���������ˮ������Ӧ�Ļ�ѧ����ʽ ��
III��̫��������
���ù��ֽܷ�ˮ����Ҫ�д����IJ��롣�����йش�����˵����ȷ����
A��ʹ�ø�Ч�����ֽ�ˮ�Ƶ�H2��ͬʱ�����Ի������
B��ʹ�ø�Ч����������ˮ�����Է��ֽ�
C���轺���ж�ṹ���нϴ�ı����������������������
D�����ڿ��淴Ӧ����������������Ӧ���ʵ�ͬʱҲ�����淴Ӧ����
������λ�⻯������
�����⻯�ƣ�NaBH4��ˮ��Һ�м����ض���������Ѹ�ٵط���ˮ�ⷴӦ����ƫ�����ƺ���������д����ˮ�ⷴӦ�Ļ�ѧ����ʽ ��
����ˮƫ�����ơ��⻯þ��MgH2��������ĥ�豸�У�ͨ�����������������ѹǿ100~500 kPa��ĥ0��5~4 h�����ɵõ����⻯�ơ���ĥ��������Ҫͨ�����������������ѹǿ100~500 kPa��Ŀ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��̩��һģ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011���Ĵ�ʡ�����й㺺��ѧ�߿���ѧ��ϰ�Ծ��������棩 ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com