
| A. | 可用碳酸钠与醋酸溶液制取少量二氧化碳 | |
| B. | 将NaHCO2与Al2(SO4)3两种溶液配制泡沫灭火剂 | |
| C. | 热的纯碱溶液的去污能力更强 | |
| D. | 实验室用饱和的FeCl3溶液制取氢氧化铁胶体 |
分析 A、醋酸酸性大于碳酸,可用碳酸盐和醋酸反应生成二氧化碳;
B、碳酸氢钠和硫酸铝混合双水解生成二氧化碳,是泡沫灭火器的原理;
C、盐类的水解吸热;
D、饱和氯化铁溶液滴入沸水中加热生成氢氧化铁胶体,利用的是铁离子水解反应.
解答 解:A、醋酸酸性大于碳酸,可用碳酸盐和醋酸反应生成二氧化碳,可用碳酸钠与醋酸制取少量二氧化碳,故A符合;
B、碳酸氢钠和硫酸铝混合双水解生成二氧化碳,是泡沫灭火器的原理,故B不符合;
C、盐类的水解吸热,故升高温度对碳酸钠的水解有促进作用,则水解出的氢氧化钠的浓度升高,则去油污的能力更强,故C不符合;
D、饱和氯化铁溶液滴入沸水中加热生成氢氧化铁胶体,利用的是铁离子水解反应生成,故D不符合;
故选A.
点评 本题考查了盐类水解的分析应用,主要是一些因素分析判断,盐类水解原理的理解应用,掌握基础是解题关键,题目较简单.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
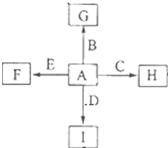 如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

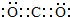 ;
; HClO+OH-;
HClO+OH-;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
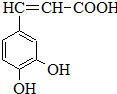 咖啡酸(如图),存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别对内脏的止血效果较好.
咖啡酸(如图),存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别对内脏的止血效果较好.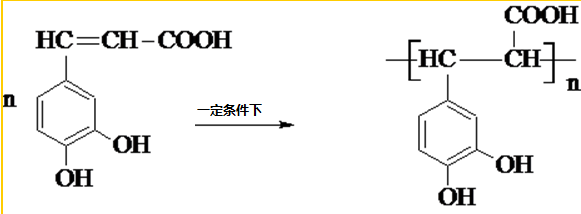 .
.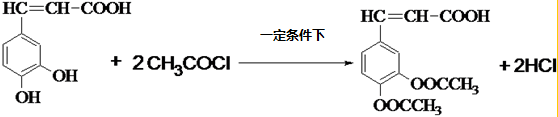 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) | |
| B. | 0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) | |
| C. | 向醋酸钠溶液中加入等量醋酸,得到的酸性混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 等物质的量浓度的①NH4Cl溶液 ②(NH4)2SO4溶液 ③NH4HSO4溶液④(NH4)2 CO3 溶液中NH4+浓度的大小关系是②>④>①>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
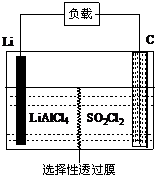 为了国防现代化,某军事科研所研发了一种新型的Li-SO2Cl2军用电池,其组成结构示意图如图所示.已知电池总反应为:2Li+SO2Cl2═2LiCl+SO2↑.下列说法中不正确的是( )
为了国防现代化,某军事科研所研发了一种新型的Li-SO2Cl2军用电池,其组成结构示意图如图所示.已知电池总反应为:2Li+SO2Cl2═2LiCl+SO2↑.下列说法中不正确的是( )| A. | 电池的负极反应为:2Li-2e-═2Li+ | |
| B. | 工作时电流方向:锂电极→导线→负载→碳棒 | |
| C. | 正极电极反应为:SO2Cl2+2e-═2Cl-+SO2↑ | |
| D. | 电池工作时,会在碳棒表面看到气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液呈碱性的原因:HCO3-+H2O?CO32-+H3O+ | |
| B. | 向明矾溶液中逐滴加入Ba(OH)2溶液至沉淀质量最大:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| C. | 氢氧化铝溶于醋酸溶液:Al(OH)3+3H+═Al3++3H2O | |
| D. | 氯化铝溶液中加入过量氨水Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com