
分析 (1)如果两个电极都是Cu片,电解硫酸铜溶液时,实际上是电镀,阳极上溶解的Cu和阴极析出的Cu质量相等;
(2)若阳极为纯锌,阴极为铜片,阳极上Zn失电子发生氧化反应;
(3)如不考虑H+在阴极上放电,电解时阴极上铜离子放电生成Cu,根据Cu和转移电子之间的关系式计算析出Cu的质量.
解答 解:(1)如果两个电极都是Cu片,电解硫酸铜溶液时,实际上是电镀,阳极上溶解的Cu和阴极析出的Cu质量相等,所以相当于硫酸铜不参加反应,则溶液浓度不变,故答案为:浓度不变;
(2)若阳极为纯锌,阴极为铜片,阳极上Zn失电子发生氧化反应,电解反应式为Zn-2e-=Zn2+,
故答案为:Zn-2e-=Zn2+;
(3)如不考虑H+在阴极上放电,电解时阴极上铜离子放电生成Cu,电极反应式为Cu2++2e-=Cu,根据Cu和转移电子之间的关系式得m(Cu)=$\frac{0.04mol}{2}×64g/mol$=1.28g,
故答案为:1.28;Cu2++2e-=Cu.
点评 本题考查电解原理,侧重考查分析及计算能力,注意电解中如果阳极是较活泼金属,阳极上金属失电子而不是电解质溶液中阴离子失电子,为易错点.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 升温增压 | B. | 降温减压 | C. | 升温减压 | D. | 降温增压 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCO3、MgO、Mg3N2 | B. | Mg(OH)2、MgO、MgCO3 | C. | MgO、Mg3N2、C | D. | Mg3N2、C、MgCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl 和Ag2CrO4 的溶解度相等 | |
| B. | 由Ksp的相对大小可以直接判断出AgCl的溶解度大于 Ag2CrO4 | |
| C. | 两者类型不同,不能由Ksp的大小直接判断溶解能力的大小 | |
| D. | 都是难溶盐,溶解度无意义 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
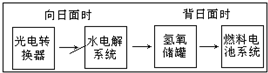 如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )
如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )| A. | 燃料电池系统产生的能量实际上来自于水 | |
| B. | 该能量转化系统中的水也是可能循环的 | |
| C. | 水电解系统中的阳极反应:4OH--4e-=2H2O+O2↑ | |
| D. | 燃料电池放电时的负极反应:H2-2e-+2OH-=2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com