
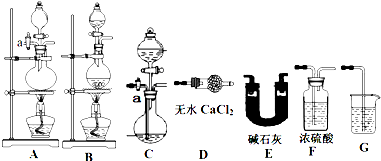
(8分)某小组取一定质量的FeSO4固体,利用下图装置进行实验。
| | 实验过程 | 实验现象 |
| ① | 通入一段时间N2,加热 | A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
| ② | 用带有火星的木条靠近装置D的导管口 | 木条复燃 |
| ③ | 充分反应,停止加热,冷却后,取A中固体,加盐酸 | 固体溶解,溶液呈黄色 |
| ④ | 将③所得溶液滴入D试管中 | 溶液变为浅绿色 |
(1)Fe2O3+6H+=2Fe3++3H2O (2)SO2 因为有Fe2O3生成,在FeSO4中只有+6价S元素有氧化性,能被还原。因此一定有SO2生成。
(3)2Fe3++SO2+2H2O = 2Fe2++SO42-+4H+
(4)不正确,因为分解有O2和SO2生成,在水溶液中发生反应:2SO2+O2+2H2O = 2H2SO4,故无论分解反应是否有SO3生成,都会有此现象
解析试题分析:同样的根据试验的现象分析综合,可以得到以下信息:①中现象D试管中有无色液体,已知:SO2熔点–72℃,沸点–10℃;SO3熔点16.8℃,沸点44.8℃。所以生成物肯定有SO2。①中现象A中固体变为红棕色,生成了Fe2O3③充分反应,停止加热,冷却后,取A中固体,加盐酸,固体溶解,溶液呈黄色是FeCl3。
②中用带有火星的木条靠近装置D的导管口,木条复燃,肯定有O2。所以基本点信息就可以确定。
(1)实验③反应的离子方程式是Fe2O3+6H+=2Fe3++3H2O(2)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有SO2气体,依据是因为有Fe2O3生成,在FeSO4中只有+6价S元素有氧化性,能被还原。因此一定有SO2生成(3)实验④反应的离子方程式是2Fe3++SO2+2H2O = 2Fe2++SO42-+4H+(4)某同学依据B中的现象,认为FeSO4分解一定有SO3生成。不正确,因为分解有O2和SO2生成,在水溶液中发生反应:2SO2+O2+2H2O = 2H2SO4,故无论分解反应是否有SO3生成,都会有此现象。
考点:化学实验
点评:对实验目的,过程,现象,结论的具体分析找到突破口,联系结点,达到解决的目的。也是高考对学生实验综合素质、化学实验的分析理解能力的考查。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:阅读理解
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| V[HCl(aq)]/mL | 11.95 | 12.50 | 12.05 |
查看答案和解析>>
科目:高中化学 来源:2012届辽宁省本溪一中、庄河高中高三上学期期末联考卷三化学试卷 题型:实验题
(11分)(Ⅰ)下列实验操作或实验叙述正确的是 。
| A.可用过滤的方法除去氢氧化铁胶体中少量的氯化铁 |
| B.用酸式滴定管量取18.80mL的碳酸钠溶液 |
| C.配制0.1mol/L的硫酸时,用量筒量取浓硫酸,要洗涤量筒,否则配制的溶液浓度偏低 |
| D.振荡用饱和的碳酸钠溶液吸收乙酸乙酯的试管,发现有气泡冒出,它是CO2气体 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省湛江市高三上学期普通高考测试(一)理综化学试卷(解析版) 题型:实验题
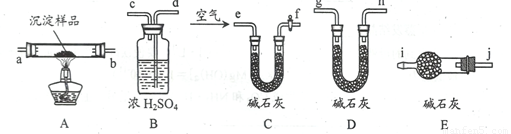
某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4。溶液中得到蓝色沉淀。关于沉淀的成分,有以下几种假设:
假设1:沉淀是CuCO3;
假设2:沉淀是Cu(OH)2;
假设3:沉淀是_____________________________________。
(1)若假设1成立,则发生反应的离子方程式为_______________________________。
(2)若假设2成立,原因是__________________________________________________。
(3)该研究性学习小组拟用以下装置测定沉淀成分,请完成下表。已知:①CuCO3和Cu(OH)2均不带结晶水;②装置气密性良好;③原装置中的空气对实验结果的影响可忽略。
|
实验步骤 |
预期现象 |
结论 |
|
①称量B、D的质量分别为ml、m2,将装置按 f→a→b→___→___→___→___→j→i顺序连接。 |
|
|
|
②称取一定质量的沉淀______________________,然后___________________,冷却后再称量B、D的质量分别为m3 、 m4 |
(1)若m1 = m3,m2 < m4 (2)若m1___m3,m2___m4 (3)若ml___m3,m2___m4 |
(1)假设1成立 (2)假设2成立 (3)假设3成立 |
(4)若沉淀样品的质量为w克,装置B质量增加了x克,则沉淀中Cu(OH)2的质量分数为__________________________。[已知Cu(OH)2的式量为98]
查看答案和解析>>
科目:高中化学 来源:2011-2012学年辽宁省、庄河高中高三上学期期末联考卷三化学试卷 题型:实验题
(11分)(Ⅰ)下列实验操作或实验叙述正确的是 。
A.可用过滤的方法除去氢氧化铁胶体中少量的氯化铁
B.用酸式滴定管量取18.80mL的碳酸钠溶液
C.配制0.1mol/L的硫酸时,用量筒量取浓硫酸,要洗涤量筒,否则配制的溶液浓度偏低
D.振荡用饱和的碳酸钠溶液吸收乙酸乙酯的试管,发现有气泡冒出,它是CO2气 体
E.实验室制取氨气时,常用无水氯化钙进行干燥
F.加入BaCl2溶液有白色沉淀产生,再加稀盐酸,沉淀不消失,一定有SO42-
(Ⅱ)某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为沉淀可能是CuCO3; 乙同学认为沉淀可能是Cu(OH)2;
丙同学认为沉淀可能是CuCO3,和Cu(OH)2的混合物。
[查阅资料知:CuCO3和Cu(OH)2均不带结晶水]
(1)按照甲同学的观点,发生反应的离子方程式为______________________ ;在探
究沉淀成分前,须将沉淀从溶液中分离并净化。其具体操作依次为 。
(2)若丙同学的观点正确,可利用下列装置通过实验测定其组成。
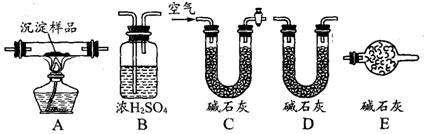
①实验装置的连接顺序为_________________________________。
②装置C中碱石灰的作用是__________,实验开始和结束时都要通过量的空气,请说明结束时通入过量空气的作用是__________________________________ 。
③若沉淀样品的质量为mg,装置B质量增加了ng,则沉淀中CuCO3的质量分数为 ______________。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年吉林省高三第一次模拟化学试卷 题型:实验题
(14分)铝镁合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁4%~6%的铝镁合金(不含其它元素)中镁的质量分数,设计了多种实验方案,其中之一是:将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。按要求填写下列空白:
1.称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。
⑴实验中发生反应的化学方程式是 。
⑵为使其反应完全,则NaOH溶液的体积V ≥ mL。
2.过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将 。
(填“偏高”、“偏低”或“无影响”)。
3. NaOH溶液的浓度可用稀硫酸测定,欲用质量分数98%(密度为1.84 g/cm3)的浓硫酸配制3 mol/L的稀硫酸100 mL。回答下列问题:
⑴需要用量筒量取浓硫酸 mL。
⑵配制操作可分解成如下几步,正确的操作顺序是 。
A.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线1~2cm时。
B.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次。
C.将冷却的稀硫酸转移到容量瓶中。
D.根据计算,用量筒取一定体积的浓硫酸。
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌。
F.盖上容量瓶塞子,振荡,摇匀。
G.用胶头滴管加蒸馏水,使溶液凹液面恰好与刻度线相切
⑶下列操作,使制得的稀硫酸溶液浓度偏小的是 (填写编号)。
A.用量筒量取一定液体时,俯视液面读数。
B.在容量瓶定容时俯视刻度线。
C.转移溶液后未洗涤烧杯和玻璃棒。
D.容量瓶刚用蒸馏水洗净,没有烘干。
E.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com