
【题目】若甲烷与氯气以物质的量之比1:1混合,在光照下得到的有机取代产物是( ) ①CH3Cl、②CH2C12、③CHCl3、④CCl4 .
A.只有①
B.只有③
C.①②③的混合物
D.①②③④的混合物
科目:高中化学 来源: 题型:
【题目】分别向盛有①紫色石蕊溶液 ②NaOH溶液 ③品红溶液 ④酸性高锰酸钾溶液的试管中通入SO2气体。
(1)试管①中的现象:___________发生反应的化学方程式是:_________________。
(2)试管②中发生反应的化学方程式是:_____________________,如果通入过量的SO2,则发生反应的化学方程式为:_______________________________。
(3)试管③中的现象:________,如将吸收SO2后的该溶液加热,现象:______________。
(4)试管④中的现象:____________________。
(5)上述实验中,SO2表现出酸性氧化物性质的是___________(填试管标号,下同),SO2表现出漂白性的是___________。SO2表现出还原性的是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物和硫的氧化物是导致酸雨的物质。
(1)形成酸雨的原理之一可简单表示如图:

请回答下列问题:
①酸雨的pH_____(填“>”、“<”或“=”)5.6;
②D物质的化学式为_____;
③反应b的化学方程式为_____;
(2)在一定条件下氨气亦可用来将氮氧化物转化为无污染的物质.写出氨气和二氧化氮在一定条件下反应生成氮气和水的化学方程式:____________________,反应中氧化剂是____;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化还原反应的叙述中正确的是( )
A.失去电子的反应为还原反应
B.含有氧元素的物质是氧化剂
C.氧化剂得到电子的数目和还原剂失去的电子的数目一定相等
D.氧化剂和还原剂不可能是同一种物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~J是常见的化学物质,转化关系如下图所示。A是生活中的一种调味剂,I是一种用途广泛的金属,常温下C、D、E、F、J皆为气体, H由两种元素构成,摩尔质量为41 g·mol-1。

(1)I的化学式为________,H的化学式为________。
(2)写出反应①②③④的化学方程式
①_______;②________; ③_______; ④________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究化学反应A+B═C+D的能量变化情况,某同学设计了如图所示装置.当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升.试回答下列问题:

(1)该反应为 __________ 反应(填“放热”或“吸热”).
(2)A和B的总能量比C和D的总能量 __________ (填“高”或“低”).
(3)物质中的化学能通过化学反应转化成 ________________ 释放出来.
(4)反应物化学键断裂吸收的能量 ______ (填“高”或“低”)于生成物化学键形成放出的能量.
(5)写出一个符合题中条件的化学方程式: ________________________________________________________________________________
Ⅱ.已知:P4(白磷,s)+5O2(g)═P4O10(s)△H=-2 983.2kJmol-1①
P(红磷,s)+![]() O2(g)═
O2(g)═![]() P4O10(s)△H=-738.5kJmol-1 ②
P4O10(s)△H=-738.5kJmol-1 ②
则白磷转化为红磷的热化学方程式为 _________________________________________ .相同状况下,能量状态较低的是 __________ ;白磷的稳定性比红磷 ______ (填“高”或“低”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在做浓硫酸与铜反应的实验过程中,观察到铜片表面变黑,于是对黑色物质的组成进行实验探究。
(1)用如右图所示装置进行实验1。(加热和夹持仪器已略去)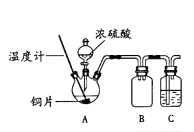
实验1:铜片与浓硫酸反应
操作 | 现象 |
加热到120℃~250℃ | 铜片表面变黑,有大量气体产生,形成墨绿色浊液 |
继续加热至338℃ | 铜片上黑色消失,瓶中出现“白雾”,溶液略带蓝色,瓶底部有较多灰白色沉淀 |
①装置B的作用是;装置C中盛放的试剂是。
②为证明A装置中灰白色沉淀的主要成分为硫酸铜,实验操作及现象是。
(2)探究实验1中120℃~250℃时所得黑色固体的成分。
【提出猜想】黑色固体中可能含有CuO、CuS、Cu2S中的一种或几种。
【查阅资料】
资料1:亚铁氰化钾[K4Fe(CN)6]是Cu2+的灵敏检测剂,向含有Cu2+的溶液中滴加亚铁氰化钾溶液,生成红棕色沉淀。
资料2:
CuS | Cu2S |
黑色结晶或粉末 | 灰黑色结晶或粉末 |
难溶于稀硫酸;可溶于硝酸;微溶于浓氨水或热的浓盐酸 | 难溶于稀硫酸和浓盐酸;可溶于硝酸;微溶于浓氨水 |
【设计并实施实验】
实验2.探究黑色固体中是否含CuO
操作 | 现象 |
i.取表面附着黑色固体的铜片5片,用清水洗干净,放入盛有10mL试剂A的小烧杯中,搅拌 | 黑色表层脱落,露出光亮的铜片 |
ii.取出铜片,待黑色沉淀沉降 | 上层溶液澄清、无色 |
①试剂A是。
②甲认为ii中溶液无色有可能是Cu2+浓度太小,于是补充实验确认了溶液中不含Cu2+ , 补充的实验操作及现象是。
实验3.探究黑色固体中是否含CuS、Cu2S
操作 | 现象 |
i.取实验2中黑色固体少许,加入适量浓氨水,振荡后静置 | 有固体剩余,固液分界线附近的溶液呈浅蓝色 |
ii.另取实验2中黑色固体少许,加入适量浓盐酸,微热后静置 | 有固体剩余,溶液变成浅绿色 |
【获得结论】由实验2和实验3可得到的结论是:实验1中,120℃~250℃时所得黑色固体中。
【实验反思】
分析实验1中338℃时产生现象的原因,同学们认为是较低温度时产生的黑色固体与热的浓硫酸进一步反应造成。已知反应的含硫产物除无水硫酸铜外还有二氧化硫,则黑色固体消失时可能发生的所有反应的化学方程式为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能在溶液中大量共存的一组离子是( )
A.Ag+、SO42﹣、Cl﹣
B.Fe2+、H+、NO3﹣
C.K+、Na+、NO3﹣
D.Mg2+、SO42﹣、CO32﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com