
| A. | ①③⑥ | B. | ①②⑤ | C. | ②④⑤ | D. | ①③④ |
分析 ①铵根离子与偏铝酸根离子发生双水解反应;
②常温下,pH=14的溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
③室温下水电离的c(H+)=10-13mol/L的溶液中存在大量氢离子或氢氧根离子,碳酸氢根离子与氢离子和氢氧根离子反应;
④加入Mg能放出H2的溶液中存在大量氢离子,四种离子之间不反应,都不与氢离子反应;
⑤使甲基橙变红的溶液中存在大量氢离子,四种离子之间不反应,都不与氢离子反应;
⑥室温下$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中存在大量氢离子,酸性条件下硝酸根离子能够氧化碘离子和亚铁离子.
解答 解:①NH4+、AlO2-之间发生双水解反应,在溶液中不能大量共存,故①错误;
②常温下,pH=14的溶液呈碱性,溶液中存在大量氢氧根离子,CO32-、Na+、S2-、[AI(OH)4]-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故②正确;
③室温下水电离的c(H+)=10-13mol/L的溶液呈酸性或碱性,HCO3-与氢离子和氢氧根离子反应,在溶液中一定不能大量共存,故③错误;
④加入Mg能放出H2的溶液呈酸性,溶液中存在大量氢离子,NH4+、Cl-、Na+、SO42-之间不反应,都不与氢离子反应,在溶液中能够大量共存,故④正确;
⑤使甲基橙变红的溶液呈酸性,溶液中存在大量氢离子,MnO4-、NO3-、Na+、Fe3+之间不反应,都不与氢离子反应,在溶液中能够大量共存,故⑤正确;
⑥室温下$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液呈酸性,NO3-在酸性条件下具有强氧化性,能够氧化Fe2+、I-,在溶液中不能大量共存,故⑥错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”等;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | X 的简单氢化物的热稳定性比 W 的强 | |
| B. | Y 的简单离子与 X 的具有相同的电子层结构 | |
| C. | 由Y 与 Z 两种元素组成的化合物是离子化合物 | |
| D. | 原子半径:r( W)<r(X)<r(Y)<r(Z) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
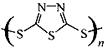 ]作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性.下列关于此种多硫化合物的叙述正确的是( )
]作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性.下列关于此种多硫化合物的叙述正确的是( )| A. | 这是一种新型无机非金属材料 | |
| B. | 此化合物可能发生加成反应 | |
| C. | 原电池的负极反应将是单体 转化为 转化为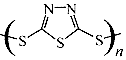 的过程 的过程 | |
| D. | 当电路中转移0.02mol电子时,将消耗原电池的正极反应材料1.48g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
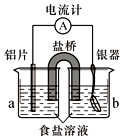 银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故.将变黑的银质器皿放入图装置,一段时间后发现黑色会褪去.回答下列问题:
银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故.将变黑的银质器皿放入图装置,一段时间后发现黑色会褪去.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 实验 目的 | 除去海带中 的有机物 | 粗盐提纯 | 用海水制取蒸馏水 | 用乙醇萃取 溴水中的溴 |
| 装置 |  | 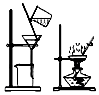 |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③ | |
| B. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| C. | pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:C(Na+)+c(H+)=c(OH-)+c(HC2O4-) | |
| D. | pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、NH4+、H3O+ | B. | OH-、H2O、F- | C. | H3O+、NH4+、NH2- | D. | Cl-、K+、H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | CH2=CH2+HBr→CH3CH2Br | ||
| C. | 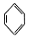 +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$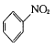 +H2O +H2O | D. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com