
科目:高中化学 来源: 题型:阅读理解
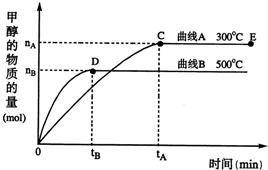 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):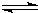 CH3OH(g)
CH3OH(g)| c(CH3OH) |
| c(CO)?c2(H2) |
| c(CH3OH) |
| c(CO)?c2(H2) |
| 2nB |
| 3tB |
| 2nB |
| 3tB |
| 1 |
| 2 |
| n(H2) |
| n(CH3OH) |
 2Cu+CO2
2Cu+CO2 2Cu+CO2
2Cu+CO2| 点燃 |
| 点燃 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 I.在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,
I.在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中, 2X
2X 2X
2X 2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是
2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是
 2SO3 的两个素材:
2SO3 的两个素材:

查看答案和解析>>
科目:高中化学 来源: 题型:
 在一定条件下可用SnO2/Al2O3等多种催化剂实现丙烯选择性还原NOx,
在一定条件下可用SnO2/Al2O3等多种催化剂实现丙烯选择性还原NOx,查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
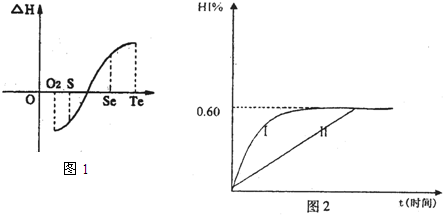
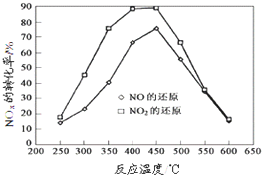
| H | + 4 |
| O | - 2 |
| H | + 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com