
| A.SO2、SO3都是极性分子 |
| B.在NH4+和[Cu(NH3)4]2+中都存在配位键 |
| C.元素电负性越大的原子,吸引电子的能力越弱 |
| D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性 |
科目:高中化学 来源:不详 题型:单选题
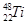 和
和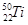 的说法中正确的是( )
的说法中正确的是( )A.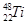 和 和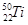 中均含有22个中子 中均含有22个中子 |
B.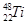 和 和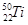 核外均有4个电子层 核外均有4个电子层 |
C.分别由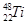 和 和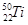 组成的金属钛单质互称为同分异构体 组成的金属钛单质互称为同分异构体 |
D.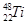 和 和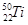 的性质完全相同 的性质完全相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
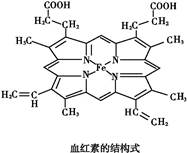
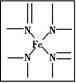
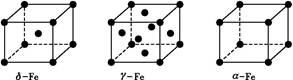
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.13153I的化学性质与12753I相同 |
| B.13153I的原子序数为53 |
| C.13153I的原子核外电子数为78 |
| D.13153I的原子核内中子数多于质子数 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应前后碳原子的杂化类型不变 |
| B.键角的大小关系:CO2>CH4>H2O |
| C.第一电离能大小关系:N>O>C>B>H |
| D.生成物H3BNH3中存在配位键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若X+和Y2-的核外电子层结构相同,则原子序数:X>Y |
| B.由水溶液的酸性:HCl>H2S,可推断元素的非金属性:Cl>S |
| C.硅、锗都位于金属与非金属的交界处,都可以作半导体材料 |
| D.Cs和Ba分别位于第六周期ⅠA和ⅡA族,则碱性:CsOH>Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | | | | X |
| Y | | | W | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2与H3属于同素异形体 |
| B.O2与O4属于同位素 |
| C.C60的质量数为 720 g/mol |
| D.N5+中含有36个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com