
| 物质 | 杂质 | 所选试剂 | ||
| CO2 | SO2 | |||
| NH3 | H2O | |||
| Cl2 | HCl | |||
| Fe | Al |
| ||
| ||
| ||
| ||
| ||
| ||
| 0.006 |
| 0.002 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可用半透膜除去淀粉溶液中的少量NaCl |
| B、黄河入海口容易形成沙洲 |
| C、将植物油倒入水中用力搅拌可形成油水混合物 |
| D、一束平行光线通过蛋白质溶液,从侧面可以看到一条光亮的通路 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu溶于稀硝酸HNO3:Cu+2H++NO3-=Cu2++NO2↑+H2O |
| B、试剂瓶玻璃塞被烧碱溶液腐蚀:SiO2+2Na++2OH-=Na2SiO3↓+H2O |
| C、向NaAlO2溶液中通入过量CO2:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- |
| D、用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中和反应反应热的测定实验中,用温度计测完盐酸的温度后,直接继续测量NaOH溶液的温度 |
| B、中和反应反应热的测定实验中,将环形玻璃搅拌棒换成环形铁丝搅拌棒,不影响反应热的测定 |
| C、用50ml酸式滴定管可准确量取25.00mlKMnO4溶液 |
| D、用PH试纸测定溶液的PH时,需先用蒸馏水润湿试纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
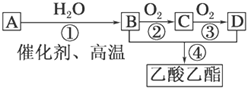 根据所给信息填空
根据所给信息填空| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com