
【题目】我国在CO2催化加氢工艺方面取得突破性进展,CO2转化过程示意图如图,下列说法不正确的是( )
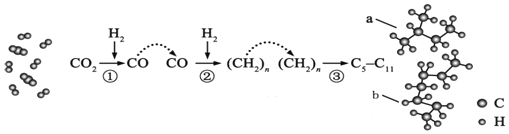
A. 过程![]() 中的产物中含有
中的产物中含有![]()
B. 该工艺在一定程度上能够拓宽获取汽油的途径
C. 产物中a和b互为同系物
D. 图中a的比例模型名称是![]() 甲基丁烷
甲基丁烷
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
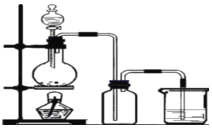
【题目】实验室制备氯气并检验氯气性质实验的装置如图。请回答:
(1)分液漏斗中盛放的液体是_____;写出圆底烧瓶中发生的反应的化学方程式_____。
(2)在集气瓶中放入湿润的红布条,滴加液体到烧瓶中,并点燃酒精灯,一段时间后集气瓶中观察到的现象是_____,烧杯中的液体是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅孔雀石是一种含铜矿石,含铜形态为![]() 和
和![]() ,同时含有
,同时含有![]() 、
、![]() 、
、![]() 、
、![]() 等杂质。以其为原料制取硫酸铜的工艺流程如图:
等杂质。以其为原料制取硫酸铜的工艺流程如图:

(1)将硅孔雀石研磨成粉的目的:__________________;步骤①中稀硫酸与![]() 反应的化学方程式:__________________。
反应的化学方程式:__________________。
(2)双氧水的作用是__________________;滤渣![]() 的主要成分为__________________。
的主要成分为__________________。
(3)步骤②调节溶液![]() ,可以选用的试剂是______。
,可以选用的试剂是______。
A. CuO B. NaOH C.Al2O3 D. Cu(OH)2
(4)有关氢氧化物开始沉淀和完全沉淀的![]() 如下表:
如下表:
氢氧化物 |
|
|
|
|
开始沉淀的 | 3.3 | 1.5 | 6.5 | 4.2 |
沉淀完全的 | 5.2 | 3.7 | 9.7 | 6.7 |
步骤②中,调节![]() ,所得滤渣
,所得滤渣![]() 的成分的化学式为____________,滤液
的成分的化学式为____________,滤液![]() 中除
中除![]() 外,还含有的金属阳离子是______。
外,还含有的金属阳离子是______。
(5)将滤液![]() 通过____________操作可得到五水硫酸铜晶体。测定硫酸铜晶体结晶水的含量时,应将其放入______中灼烧。加热失水后,若在空气中冷却称量,测定结果______(填“偏高”、“偏低”或“不变”)。
通过____________操作可得到五水硫酸铜晶体。测定硫酸铜晶体结晶水的含量时,应将其放入______中灼烧。加热失水后,若在空气中冷却称量,测定结果______(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定烧碱纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
(1)将准确称取的4.3 g烧碱样品配成250 mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有______________________。
(2)取10.00 mL待测液,用_____________式滴定管量取。
(3)用0.200 0 mol·L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视_____________,直到滴定终点。
(4)根据下列数据,烧碱的纯度为_____________(以百分数表示,小数点后保留两位)。
滴定次数 | 待测体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
(5)以标准的盐酸滴定未知浓度的氢氧化钠溶液为例,判断下列操作引起的误差(填“偏大”“偏小”“无影响”或“无法判断”)
①读数:滴定前平视,滴定后俯视_____________;
②用待测液润洗锥形瓶_____________;
③滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下的甲烷和一氧化碳的混合气体8.96 L,其质量是7.60 g,则混合气体中甲烷的体积为________,一氧化碳的质量为_______。
(2)现有CO、CO2的混合气体,根据下列条件回答问题
①若该混合气体在标准状况下的密度为1.79 g/L,则混合气体中CO的体积分数为__________。
②若标准状况下,2.24 L该混合气体的质量为4 g,则混合气体中CO和CO2的物质的量之比为_________。
(3)一定量的甲烷在O2不足的情况下燃烧,得到CO、CO2和H2O的总质量是7.2 g,若其中水的质量为3.6 g,则CO的质量是_________。
(4)在一定条件下,某固体化合物X受热分解方程式为: 2X = A↑+2B↑+3C↑,测得反应后生成的混合气体对H2的相对密度为11。在相同条件下,X的相对分子质量是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知分解1molH2O2放出热量98kJ,在含少量I-的溶液中,H2O2分解的机理为H2O2+I-→H2O+IO-(慢)、 H2O2+IO-→H2O+O2+I-(快)。 下列有关该反应的说法不正确的是( )
A. 总反应中![]() :
:![]() :1
:1
B. ![]() 的分解速率与的
的分解速率与的![]() 浓度有关
浓度有关
C. 该反应的催化剂是![]() ,而不是
,而不是![]()
D. 由于催化剂的加入降低了反应的活化能,使该反应活化能低于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液 只含Cl-、![]() 、SO4 2-、Na+、K+、Mg2+六种离子中的某几种。经实验:
、SO4 2-、Na+、K+、Mg2+六种离子中的某几种。经实验:
①原溶液加过量的 NaOH 溶液,产生白色沉淀;
②过滤,取实验①滤液加 BaCl2 溶液不产生沉淀;
③取实验①滤液加稀硝酸酸化,再加 AgNO3 溶液产生白色沉淀, 下列说法不正确的是
A.实验 ① 中的白色沉淀为 Mg(OH)2
B.实验②证明原溶液中一定没有 CO3 2-、SO4 2-
C.原溶液中一定含有的离子是 Cl-、Na+、K+、Mg2+
D.有同学认为原溶液一定有 Cl-,实验③可以省略
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作②的名称是______________,试剂a的溶质是_______________(填化学式)
(2)加入试剂b所发生反应的化学方程式为___________________________________。
(3)该方案能不能达到实验目的:_____________,若不能,应如何改进?(若能,此问不用回答)________________________________________。
(4)用分离出的固体B配制100mL 0.5mol/L的溶液B,现有如下可供选择的仪器:
A.胶头滴管 B.烧瓶 C.烧杯 D.药匙 E.量筒 F.托盘天平。
①用托盘天平称得固体B的质量是_________g。
②配制溶液B时,上述仪器中一定不需要使用的有_____________(填字母),还缺少的仪器有__________________________________(写仪器名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里常用Na2O2与H2O反应快速制取少量的O2,下面装置用来制取O2并演示Na在O2中的燃烧实验。
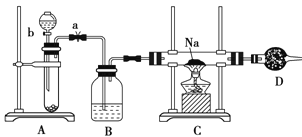
(1)关闭装置中的止水夹a后,开启活塞b,漏斗中液体不断地往下滴,直至全部流入试管。试判断装置是否漏气________(填“漏气”、“不漏气”或“无法确定”),判断理由是_________________。
(2)写出A装置中反应的化学方程式并标出电子得失情况:_____________。
(3)B装置中盛放的试剂是__________________,其作用是____________。
(4)C装置中观察到的现象是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com