
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得: 3SiO2(s)+6C(s)+2N2(g)═Si3N4(s)+6CO(g)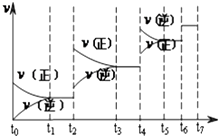
(1)该反应的平衡常数表达式为K=
(2)若知上述反应为放热反应,则其反应热△H0(填“>”、“<”或“=”);升高温度,其平衡常数值(填“增大”、“减小”或“不变”); 若已知CO生成速率为v(CO)=18molL﹣1min﹣1 , 则N2消耗速率为v(N2)=
(3)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图.图中t4时引起平衡移动的条件可能是;
(4)图中表示平衡混合物中CO的含量最高的一段时间是 .
(5)已知:2H2(g)+O2(g)═2H2O(g);△H=﹣483.6kJmol﹣1;H2O(g)=H2O(l)△H=﹣44kJmol﹣1 , ;由此可知H2燃烧热化学方程式为 .
【答案】
(1)![]()
(2)<;减小;6mol?L﹣1?min﹣1
(3)增大压强或升高温度
(4)t3~t4
(5)H2(g)+ ![]() O2(g)═H2O(g);△H=﹣285.8?mol﹣1
O2(g)═H2O(g);△H=﹣285.8?mol﹣1
【解析】解:(1)可逆反应3SiO2(s)+6C(s)+2N2(g)Si3N4(s)+6CO(g)的平衡常数K= ![]() ; 所以答案是:K=
; 所以答案是:K= ![]() (2)对于放热反应,反应热△H<0;对于放热反应,温度升高,平衡逆向移动,K减小;已知CO生成速率为v(CO)=18molL﹣1min﹣1 , 根据速率之比等于化学计量数之比,则N2消耗速率为v(N2)=
(2)对于放热反应,反应热△H<0;对于放热反应,温度升高,平衡逆向移动,K减小;已知CO生成速率为v(CO)=18molL﹣1min﹣1 , 根据速率之比等于化学计量数之比,则N2消耗速率为v(N2)= ![]() ×18molL﹣1min﹣1=6molL﹣1min﹣1;
×18molL﹣1min﹣1=6molL﹣1min﹣1;
所以答案是:<;减小; 6molL﹣1min﹣1(3)若不改变H2、CO的量,由图可知,t4时瞬间正、逆反应都增大,平衡向逆反应移动,改变条件为压缩体积增大压强,由(2)已知反应为放热反应,升高温度速率加快,反应逆向移动也可;
所以答案是:增大压强或升高温度 (4)t6时瞬间正、逆反应都增大,平衡不移动,故应是加入催化剂,t2时改变改变条件,平衡向正反应移动,在t3时重新到达平衡,t4时改变条件,平衡向逆反应移动,t5时由达平衡,故t3~t4平衡状态CO的含量最高;
所以答案是:t3~t4(5)已知:①2H2(g)+O2(g)═2H2O(g);△H=﹣483.6kJmol﹣1;
②H2O(g)=H2O(l)△H=﹣44kJmol﹣1 ,
根据燃烧热的热化学方程式的概念:1mol可燃物充分燃烧生成稳定氧化物的热化学方程式,由盖斯定律:
① ![]() +②可得:H2(g)+
+②可得:H2(g)+ ![]() O2(g)═H2O(g);△H=﹣285.8mol﹣1;
O2(g)═H2O(g);△H=﹣285.8mol﹣1;
所以答案是:H2(g)+ ![]() O2(g)═H2O(l);△H=﹣285.8 kJmol﹣1
O2(g)═H2O(l);△H=﹣285.8 kJmol﹣1
【考点精析】根据题目的已知条件,利用反应热和焓变和反应速率的定量表示方法的相关知识可以得到问题的答案,需要掌握在化学反应中放出或吸收的热量,通常叫反应热;反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t.


科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如右图所示。则下列离子组在对应的溶液中一定能大量共存的是

A.a点对应的溶液中:Na+、AlO2-、SO42-、NO3-
B.b点对应的溶液中:Ba2+、K+、NO3-、Cl-
C.c点对应的溶液中:Na+、Ag+、Mg2+、NO3-
D.d点对应的溶液中:Cl-、NO3-、Fe2+、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液M中含有MgCl2、KCl和AlCl3,某小组用下图所示过程对其进行处理以获得较纯净的AlCl3溶液。已知:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,请回答:
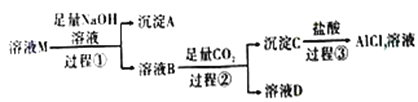
(1)沉淀A的化学式为_______,过程①中Al3+发生反应的离子方程式为_______。
(2)上述过程中的氢氧化钠溶液_____(填“能”或“不能”)用氨水代替,原因是_______。
(3)溶液B中大量存在的阳离子是______,过程③反应的离子方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华民族有着光辉灿烂的发展史。下列过程不涉及元素化合价变化的是
A. 用铁矿石炼铁 B. 黑火药爆炸
C. 石胆(石胆是硫酸铜)化铁为铜 D. 点制豆腐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铜﹣锌﹣硫酸构成的原电池中,当导线中有1mol电子通过时,理论上的两极变化是( ) ①锌片溶解32.5g ②锌片增重32.5g ③铜片上析出1gH2④铜片上析出1mol H2 .
A.①③
B.①④
C.②③
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题: 高炉炼铁是CO气体的重要用途之一,其基本反应为:FeO(s)+CO(g)Fe(s)+CO2(g)△H>0.已知在1 100℃时,该反应的化学平衡常数K=0.263.
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值(填“增大”、“减小”或“不变”);
②1100℃时测得高炉中,c(CO2)=0.025molL﹣1 , c(CO)=0.1molL﹣1 , 则在这种情况下,该反应向进行(填“左”或“右”),判断依据是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超细碳酸钙的应用非常广泛。下图为工业生产超细碳酸钙的流程图:

(1)反应池中发生反应的化学方程式为___________。
(2)将反应池中得到的固体过滤、洗涤、烘干,得到超细碳酸钙。判断固体是否洗净的操作是__________。
(3)实验小组在实验室中利用如图所示装置(部分夹持装置已略去)模拟侯氏制碱法制纯碱。

实验步骤:
I.食盐精制:粗盐(含少量Ca2+、Mg2+、SO32-)溶解,依次加入足量NaOH溶液、______溶液、_______溶液;过滤;加入盐酸调pH至7。
II.转化:①将精制后的食盐溶液控制温度在30~35℃之间;不断搅拌,先后通入足量氨气和二氧化碳气体;保温,搅拌半小时;
②静置,过滤、洗涤、烘干,得到NaHCO3晶体。
III.制纯碱:将制得的NaHCO3放入坩埚中,在酒精灯上灼烧,冷却至室温,即得到纯碱。
已知各物质在不同温度下的溶解度见右表。
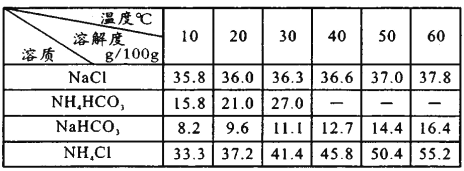
①B中应盛装________。
②C装置中发生“转化”生成NaHCO3的离子方程式是___________。
③“转化”过程中,温度控制在30~35℃之间的加热方式是_______;温度需控制在30~35℃之间的原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应14CuSO4 +5FeS2 +12H2O=7Cu2S +5FeSO4+12H2SO4,下列结论正确的是
A. FeS2既不是氧化剂,又不是还原剂
B. Cu2S 既是氧化产物,又是还原产物
C. 被氧化的硫和被还原的硫质量比是7∶3
D. 被CuSO4氧化的硫占全部被氧化的硫的2/3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气通入石灰乳制得漂白粉,其主要成分是Ca(OH)2·3CaCl( ClO)·H2O。已知次氯酸盐可与盐酸反应生成氯气,用贮存过久的漂白粉与浓盐酸制得的Cl2中,含量最多的杂质气体除水蒸气外,还可能是
A. HC1,O2 B. CO2,HCl C. HC1 ,H2 D. CO2,H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com