
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。
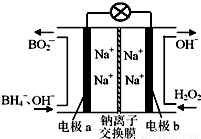
下列说法正确的是
A.电池放电时Na+从a极区移向b极区
B.每消耗3 mol H2O2,转移的电子为3 mol
C.电极a采用MnO2,MnO2既作电极材料又有催化作用
D.该电池的负极反应为:BH4-+2H2O-8e-=== BO2-+8H+
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源:2014-2015学年河北省高三12月月考化学试卷(解析版) 题型:填空题
A、B、C、D、E五种短周期元素(A、B、C、D、E分别代表元素符号),它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的=3/4倍;C与E同主族。请回答下列问题:
(1)X的化学式为______
(2)元素的非金属性C______E(填“>”、“<”或“=”),下列各项中,能说明这一结论的事实有______(填序号)。
①氢化物H2E的酸性比H2C强
②氢化物H2C的热稳定性比H2E强
③氢化物H2E的水溶液放置在空气中会变浑浊
(3)将由BC和BC2组成的混合气体通入下图所示装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强。

已知(ⅰ)浓硝酸能将气体BC氧化成BC2,而稀硝酸不能氧化BC。
(ⅱ)NaOH溶液与BC2反应的化学方程式为:
2NaOH+2BC2 NaBC2+NaBC + H2O
NaBC2+NaBC + H2O
NaOH溶液与BC气体不反应
a.装置①、②、③中盛放的药品依次是______、______、______。
b.通入混合气体之前,应先通入一段时间某另外一种气体,试推测先通入的该气体可以是______(填一种气体的化学式)。
c.能够说明实验已成功的现象是___________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省保定市高三12月联考化学试卷(解析版) 题型:选择题
化学与生产、生活、环境等社会实际密切相关。下列叙述正确的是
A.减少机动车尾气的排放,可以降低雾霾的发生
B.加强化石燃料的开采利用,能从根本上解决能源危机
C.推广使用煤液化技术,可减少二氧化碳等温室气体的排放
D.绿色食品是生产时不使用化肥农药,不含任何化学物质的食品
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高三11月月考化学试卷(解析版) 题型:实验题
(14分)氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,熔点为-80℃,沸点137.1℃。在空气中强烈发烟,易与水发生水解反应。人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能。在熔融的硫中通入氯气即可生成S2Cl2。下图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去)。
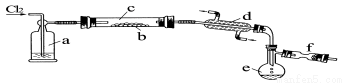
(1)已知S2Cl2分子结构与H2O2相似,请写出S2Cl2的电子式 。
(2)装置a中应放试剂为 ,其作用为 ;装置c为何水平放置 ;
(3)该实验的操作顺序应为 (用序号表示)。
①加热装置c ②通入Cl2 ③通冷凝水 ④停止通Cl2 ⑤停止加热装置c
(4)f装置中应放置的试剂为 ,其作用为 。
(5)已知S2Cl2水解时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高三11月月考化学试卷(解析版) 题型:选择题
下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向两份蛋白质溶液中分别滴加饱和NaCl 溶液和CuSO4 溶液 | 均有固体析出 | 蛋白质均发生变性 |
B | 向溶液X 中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X 中一定含有SO42- |
C | 用大理石和盐酸反应制取CO2 气体,立即通入一定浓度的Na2SiO3 溶液中 | 出现白色沉淀 | H2CO3的酸性比H2SiO3的酸性强 |
D | 向浓度均为0. 1 mol·L-1 NaCl 和NaI 混合溶液中滴加少量AgNO3 溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中化学试卷(解析版) 题型:填空题
已知草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂。
(1)草酸的电离方程式为 。
(2)将草酸溶液与酸性高锰酸钾溶液混合发生的反应为:
MnO4-+ H2C2O4+ → Mn2+ + CO2↑+ H2O
某合作小组同学在烧杯中进行上述反应时,发现刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快。
①配平上述离子方程式
②该实验不久后溶液突然褪色的原因最有可能是 。
A.体系压强增大 B.反应物接触面积增大
C.生成物对反应有催化作用 D.反应物浓度增大
(3)为研究该化学反应速率的影响因素,某同学进行了以下实验:
组别 | 温度/℃ | V(H2C2O4) /mL | V(KMnO4) /mL | V(H2O) /mL | KMnO4溶液 褪色时间/s |
1 | 30 | 10 | 10 | 20 | 40 |
2 | 30 | 20 | 20 | 0 | t |
3 | 30 |
|
| 15 |
①对比实验1和3要研究改变反应物浓度对化学反应速率的影响,请完成表格中横线。
②实验2中溶液褪色时间t 为
A.>40 B.=40 C.<40 D.无法判断
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中化学试卷(解析版) 题型:选择题
现有0.1 mol·L-1的醋酸溶液,下列说法正确的是
A.加水稀释,溶液中所有离子的浓度都减小
B.溶液中n(CH3COO— )+n(CH3COOH)=0.1mol
C.升高温度,醋酸的电离度增大
D.中和1L等物质的量浓度的NaOH溶液所消耗的醋酸体积大于1L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中化学试卷(解析版) 题型:选择题
下列反应既属于氧化还原反应,又属于吸热反应的是
A.铝热反应
B.氯气和氢气混合后见光发生爆炸
C.Ba(OH)2?8H2O晶体与NH4Cl晶体的反应
D.工业上用焦炭制水煤气
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中化学试卷(解析版) 题型:选择题
在图1所示密闭容器中充满红棕色的NO2气体,当迅速将活塞向右推一段距离后保持活塞不动时,色度计测出颜色变化的情况如图2所示。如果迅速将活塞往左拉一段距离后保持活塞不动时,色度计测出颜色变化的情况正确的图示为
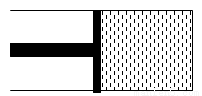
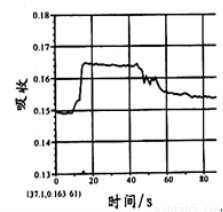
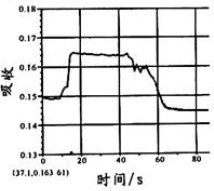
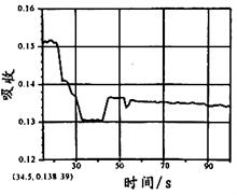
A. B.
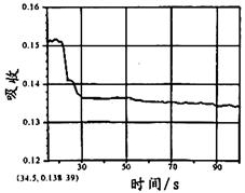
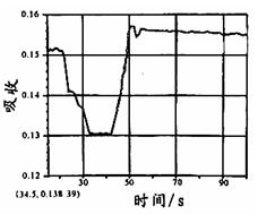
C. D .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com