
【题目】为探究某盐X(仅含四种元素,其摩尔质量小于300g/mol)设计并完成如下实验:
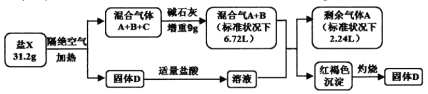
已知:气体A为单质,标准状况下的密度为1.25g/L。请回答:
(1)盐X的组成元素为H、O和____________(用元素符号表示)。
(2)写出固体D和过量HI溶液反应的离子方程式__________。
(3)写出盐X隔绝空气加热分解的化学方程式__________。
【答案】N、Fe Fe2O3+6H++2I—=2Fe2++I2+3H2O 2(NH4)2FeO4![]() Fe2O3+2NH3↑+N2↑+5H2O
Fe2O3+2NH3↑+N2↑+5H2O
【解析】
通过各物质的所含元素的物质的量的比例,可以知道该物质的分子式。
混合气体A+B+C通过碱石灰,碱石灰增重9g,H2O或者CO2,或者两者的混合物的质量为9g。混合气体通过溶液后,生成了红褐色沉淀。红褐色沉淀为Fe(OH)3,则混合气体中含有NH3。气体A为单质,标准状况下的密度为1.25 g·L-1,则其摩尔质量为22.4L·mol-1×1.25g·L-1=28g·mol-1,则气体A为氮气,其物质的量为0.1mol,质量为2.8g。B气体为NH3,其物质的量![]() ,质量为3.4g。则盐含有的元素为N、H、Fe。如果气体C为CO2,所含元素种类超过了4种,则气体C为H2O,另一种元素为O。H2O的质量为9g,物质的量为0.5mol。盐X的质量为31.2g, 气体A+B+C的总质量为2.8g+3.4g+9g=15.2g。则分解生成D的质量为31.2g-15.2g=16g,则Fe2O3的物质的量
,质量为3.4g。则盐含有的元素为N、H、Fe。如果气体C为CO2,所含元素种类超过了4种,则气体C为H2O,另一种元素为O。H2O的质量为9g,物质的量为0.5mol。盐X的质量为31.2g, 气体A+B+C的总质量为2.8g+3.4g+9g=15.2g。则分解生成D的质量为31.2g-15.2g=16g,则Fe2O3的物质的量![]() 。该分解反应生成的H2O、NH3、N2、Fe2O3的物质的量分别为0.5mol、0.2mol、0.1mol、0.1mol,则H、N、O、Fe的物质的量为1.6mol、0.4mol、0.8mol、0.2mol,比例为8:2:4:1。该反应为铵盐分解,则分子式为H8N2O4Fe,化学是为(NH4)2FeO4。
。该分解反应生成的H2O、NH3、N2、Fe2O3的物质的量分别为0.5mol、0.2mol、0.1mol、0.1mol,则H、N、O、Fe的物质的量为1.6mol、0.4mol、0.8mol、0.2mol,比例为8:2:4:1。该反应为铵盐分解,则分子式为H8N2O4Fe,化学是为(NH4)2FeO4。
(1)根据上述的分析,盐X所含元素有H、O外,还有N和Fe;
(2)Fe2O3是碱性氧化物,HI为强酸,生成盐和水,但是生成Fe3+能够将I-氧化成I2,Fe3+还原成Fe2+,为氧化还原反应,则化学方程式为Fe2O3+6H++2I—=2Fe2++I2+3H2O;
(3)根据上述分析盐X为(NH4)2FeO4,其分解产物包括了H2O、Fe2O3、N2、NH3,该反应为氧化还原反应,Fe的化合价从+6降低到+3,还原产物Fe2O3中2个Fe,化合价总共降低6价,NH4+中的部分N的化合价从-3升高到0,N2中有2个N原子,化合价总共升高6价,化合价升降守恒,则还原产物Fe2O3和氧化产物N2的比例为1:1,则根据原子守恒和化合价守恒,化学方程式为2(NH4)2FeO4![]() Fe2O3+2NH3↑+N2↑+5H2O。
Fe2O3+2NH3↑+N2↑+5H2O。


科目:高中化学 来源: 题型:
【题目】无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:
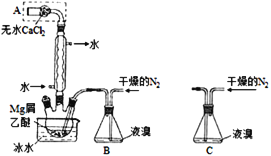
图1 图2
步骤1、三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴;
步骤2、缓慢通入干燥的氮气,直至溴完全导入三颈瓶中;
步骤3、反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品;
步骤4、室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg与Br2反应剧烈放热;MgBr2具有强吸水性;
②MgBr2+3C2H5OC2H5![]() MgBr23C2H5OC2H5
MgBr23C2H5OC2H5
请回答:
(1)仪器A的名称是______;
(2)实验中不能用干燥空气代替干燥N2,原因是______________;
(3)步骤3中,第一次过滤除去的物质是_________________;
(4)有关步骤4的说法,正确的是__________________;
A.可用95%的乙醇代替苯溶解粗品 B.洗涤晶体可选用0℃的苯
C.加热至160℃的主要目的是除去苯 D.该步骤的目的是除去乙醚和可能残留的溴
(5)为测定产品的纯度,可用EDTA(简写为Y)标准溶液滴定,反应的离子方程式:Mg2++Y4﹣═MgY2
①滴定管洗涤前的操作是_______________________;
②测定时,先称取0.2500g无水MgBr2产品,溶解后,用0.0500molL﹣1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液25.00mL,则测得无水MgBr2产品的纯度是__________(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】假如12C相对原子质量为24,以0.024kg12C所含的12C原子数为阿伏加德罗常数(NA),则下列说法正确的是( )
A.此时CO2的摩尔质量为88gmol﹣1
B.标准状况下44gCO2体积约为11.2L
C.44gCO2与28gCO含有相同数目的原子
D.NA个O2大约为6.02×1023个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《汉书景帝纪》记载,我国用锌的历史可追溯到西汉或更早。请回答:
(1)基态Zn原子的价层电子轨道表达式为___;占据最高能层的电子,其电子云轮廓图形状为____。
(2)与相邻元素Ga相比,元素Zn的第一电离能较大的原因为___。
(3)Zn2+可与CN-、二苯硫腙 等形成稳定配合物。
等形成稳定配合物。
①CN-的结构式为___。
②每个二苯硫腙分子中,采取sp2杂化的原子有___个。
(4)卤化锌的熔点如表所示:
ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
熔点/℃ | 872 | 275 | 394 | 446 |
①ZnCl2、ZnBr2、ZnI2的熔点呈表中变化规律的原因____。
②ZnF2的熔点远高于其它三种卤化锌,其原因为___。
(5)ZnS的某种晶胞结构如图所示。已知该晶体的密度为dg.cm-3,S2-和Zn2+半径分别为apm、bpm,阿伏伽德罗常数的数值为NA。
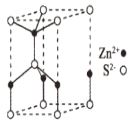
①Zn2+的配位数为___。
②该晶胞中离子的体积占晶胞体积的百分率为__(列式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用人工模拟光合作用合成甲酸的原理为2CO2+2H2O=2HCOOH+O2,装置如图所示,下列说法不正确的是( )
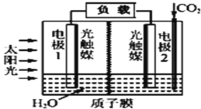
A.该装置能将太阳能转化为化学能和电能
B.电子由电极1经过负载流向电极2
C.电极2的反应式:CO2+2H++2e-=HCOOH
D.电极1周围pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)科学家提出由CO2制取C的太阳能工艺如图所示。

①若“重整系统”发生的反应中n(FeO)/n(CO2)=6,则FexOy的化学式为____________。
②“热分解系统”中每分解1mol FexOy,转移电子的物质的量为________。
(2)工业上用CO2和H2反应合成二甲醚。已知:CO2(g)+ 3H2(g)═CH3OH(g)+ H2O(g) △H1=-53.7kJ/mol,CH3OCH3(g)+H2O(g) ═ 2CH3OH(g) △H2=+23.4kJ/mol,则2CO2(g)+ 6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3=______kJ/mol。
CH3OCH3(g)+3H2O(g) △H3=______kJ/mol。
①一定条件下,上述合成甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是_____(填代号)。
a.逆反应速率先增大后减小 b.H2的转化率增大
c.反应物的体积百分含量减小 d.容器中的nCO2/nH2值变小
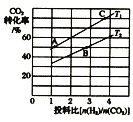
②在某压强下,合成甲醚的反应在不同温度、不同投料比时,CO2的转化率如图所示。T1温度下,将6 mol CO2和12molH2充入2L的密闭容器中,5 min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3) =___;KA、KB、KC三者之间的大小关系为_____。
(3)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中:c (NH4+)_____c(HCO3-)(填“>”、“<”或“=”);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=__________________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7mol·L-1,K2=4×10-11mol·L-1)
NH3·H2O+H2CO3的平衡常数K=__________________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7mol·L-1,K2=4×10-11mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法能说明反应2HI(g)![]() H2(g)+I2(g)已达到平衡状态的是( )
H2(g)+I2(g)已达到平衡状态的是( )
①单位时间内生成nmol H2的同时生成nmol HI
②一个H-H键断裂的同时有两个H-I键断裂
③当v正(HI)=2v逆(I2)时
④反应速率:v(H2)=v(I2)=0.5v(HI)
⑤当c(H2):c(I2):c(HI)=1:1:2时
⑥温度和体积一定时,某一生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧温度和体积一定时,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体的颜色不再发生变化
⑩温度和压强一定时,混合气体的密度不再发生变化
A.②③⑥⑨B.①②⑤⑨⑩C.③⑥⑦⑩D.②⑥⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据图1中氮元素及其化合物的转化关系,回答问题:
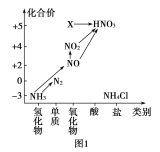
(1)实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为_________。
(2)下列试剂不能用于干燥NH3的是__________。
A.浓硫酸 B.碱石灰 C.NaOH固体
(3)工业上以NH3、空气、水为原料生产硝酸分为三步:
①NH3→NO的化学方程式为______________。
②NO→NO2反应的实验现象是____________。
③NO2+H2O→HNO3中氧化剂与还原剂物质的量之比为______。
(4)图1中,实验室只用一种物质将NO直接转化为硝酸且绿色环保,则该物质的化学式为_____。
(5)若要将NH3→N2,从原理上看,下列试剂可行的是______。
A.O2 B.Na C.NH4Cl D.NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4NH3+5O2![]() 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列关系表示正确的是( )
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列关系表示正确的是( )
A. 5v(NH3)/6=v(O2)B. 5v(O2)/6=v(H2O)
C. 2v(NH3)/2=v(H2O)D. 4v(O2)/5=v(NO)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com