
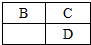
 A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如图所示,A是短周期中原子半径最小的元素,A、B、C三种元素的原子序数之和等于D元素的原子序数,E是短周期中最活泼的金属元素.下列说法错误的是( )
A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如图所示,A是短周期中原子半径最小的元素,A、B、C三种元素的原子序数之和等于D元素的原子序数,E是短周期中最活泼的金属元素.下列说法错误的是( )| A. | 氢化物的稳定性:B>D | B. | 简单离子的半径大小:D>E>C | ||
| C. | 简单阴离子的还原性:C<D | D. | A、B、C可形成离子化合物 |
分析 A、B、C、D、E均为短周期主族元素,A是短周期中原子半径最小的元素,则A为H;E是短周期中最活泼的金属元素,则E为Na;结合B、C、D在周期表中的位置关系,设C的原子序数为x,则B的原子序数为x-1,D的原子序数为x+8,由A、B、C三种元素的原子序数之和等于D元素的原子序数,则1+x-1+x=x+8,解得x=8,即C为O,B为N,D为S,然后结合元素周期律及元素化合物知识来解答.
解答 解:A、B、C、D、E均为短周期主族元素,A是短周期中原子半径最小的元素,则A为H;E是短周期中最活泼的金属元素,则E为Na;结合B、C、D在周期表中的位置关系,设C的原子序数为x,则B的原子序数为x-1,D的原子序数为x+8,由A、B、C三种元素的原子序数之和等于D元素的原子序数,则1+x-1+x=x+8,解得x=8,即C为O,B为N,D为S,
A.非金属性N>S,氢化物的稳定性:B>D,故A正确;
B.电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则简单离子的半径大小:D>C>E,故B错误;
C.非金属性O>S,则简单阴离子的还原性:C<D,故C正确;
D.A、B、C可形成离子化合物硝酸铵,故D正确;
故选B.
点评 本题考查位置、结构与性质的应用,为高频考点,把握元素的位置、原子序数关系、元素化合物等推断元素为解答的关键,侧重分析与应用能力的考查,注意短周期、原子序数等信息的应用,题目难度不大.


科目:高中化学 来源:2016-2017学年黑龙江大庆一中高一上10月月考化学试卷(解析版) 题型:选择题
离子方程式BaCO3+2H+=CO2↑+H2O+Ba2+中的H+能代表的物质是( )
①HCl ②H2SO4 ③HNO3 ④NaHSO4 ⑤CH3COOH
A. ②④⑤ B.①④⑤ C.①⑤ D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 因为氯化铝是分子晶体,所以工业制备金属铝不采用电解氯化铝溶液,但工业制取金属镁可以采用电解氯化镁溶液的方法 | |
| B. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体c(Mg2+)增大 | |
| C. | 鸡蛋清中加入2滴1%醋酸铅溶液后会产生沉淀,因为蛋白质发生了变性 | |
| D. | 在BaSO4悬浊液中加入饱和碳酸钠溶液,过滤、洗涤得固体,再加盐酸产生气体.可证明Ksp(BaSO4)<Ksp(BaCO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
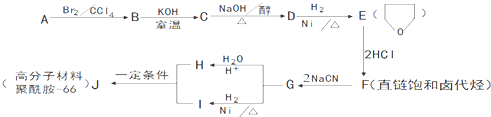
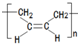
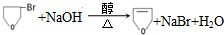 .
. .
. .
.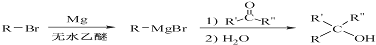
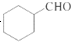 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 实验操作 | 预期现象 | 结论 | |
| 验证猜想Ⅰ | 步骤①:取少量0.01mol/L酸性KMnO4溶液,滴入所得溶液 | 溶液紫红色褪去 | 含有Fe2+(或溶液紫红色不褪去,不含Fe2+) |
| 步骤②:另取少量所得溶液,滴加KI-淀粉溶液 | 含有Fe3+ | ||
| 验证猜想Ⅱ | 将所得气体通入如图装置: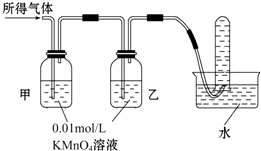 | 甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变,试管中收集到气体 | 含有两种气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有③④ | C. | 只有②③④ | D. | ①②③④都正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol/L的稀盐酸1L | B. | 73g HCl | ||
| C. | 44.8 L HCl | D. | 1.204×1024个HCl分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
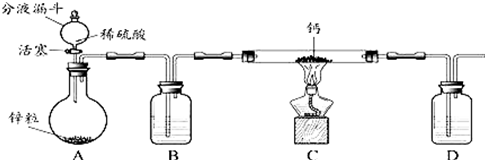
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.0004mol/(L•min) | B. | 0.0002mol/(L•s) | C. | 0.0016 | D. | 0.012 mol/(L•min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com