
| A. | 1:1 | B. | n:(n+1) | C. | 1:(n+1) | D. | (n+1):n |
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:选择题
| A. | 燃料燃烧产物CO2是温室气体之一 | |
| B. | 化石燃料完全燃烧不会造成大气污染 | |
| C. | 以液化石油气代替燃油可减少大气污染 | |
| D. | 燃料不完全燃烧排放的CO是大气污染物之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
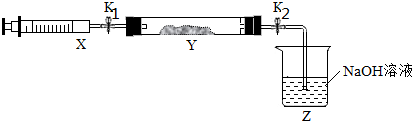
| 操作步骤 | 实验现象 | 解释原因 |
| 打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中 | ①Y管中红棕色气体慢慢变浅 | ②反应的化学方程式 8NH3+6NO2$\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O |
| 将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝聚 |
| 打开K2 | ③Z中NaOH溶液产生倒吸现象 | ④反应后气体分子数减少,Y管压强小于外压 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
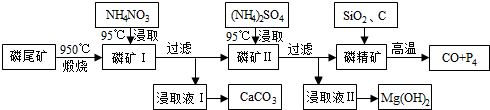
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:10:100:1000 | B. | 1011:1010:10:1 | C. | 1:10:1010:1011 | D. | 14:13:2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、OH-、NO3- | B. | Ba2+、H+、SO42- | C. | K+、OH-、CO32- | D. | Fe3+、Cl-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有0.1molNH3•H2O | |
| B. | 溶液中NH3的物质的量浓度为0.2mol•L-1 | |
| C. | NH3和NH3•H2O的物质的量浓度之和为0.2mol•L-1 | |
| D. | NH3、NH3•H2O和NH4+的物质的量之和为0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
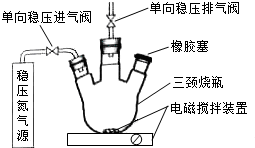 水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg•L-1.我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg•L-1.某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO.
水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg•L-1.我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg•L-1.某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
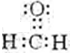 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com