
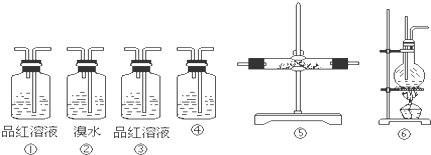
| ||
| ||
| ||


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
2 1 |
| A、0.4 mol中子 |
| B、0.2 mol电子 |
| C、0.2 mol质子 |
| D、0.4 mol分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
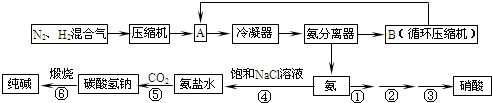
查看答案和解析>>
科目:高中化学 来源: 题型:
 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:| 温度 实验次数 | 起始温 度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、实验室制氨气:NH4++OH-
| ||||
| B、向NaHCO3溶液中滴入少量澄清的石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | ||||
| C、酸性KMnO4溶液与H2O2反应:2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O | ||||
| D、碳酸钙与醋酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H2O/H- |
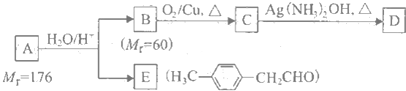
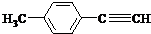 )的一条路线如下:
)的一条路线如下: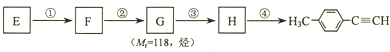
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生成的水分子中含有18O |
| B、生成的乙酸乙酯中含有18O |
| C、可能生成88g乙酸乙酯 |
| D、不可能生成90g乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
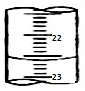 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.00 | 20.30 |
| 第二次 | 25.00 | 0.00 | 20.20 |
| 第三次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com